En 1889, Svante Arrhenius a proposé l’équation d’Arrhenius à partir de ses observations directes des graphiques des constantes de vitesse en fonction des températures :
\
L’énergie d’activation, Ea, est l’énergie minimale que les molécules doivent posséder pour réagir et former un produit. La pente du tracé d’Arrhenius peut être utilisée pour trouver l’énergie d’activation. Le diagramme d’Arrhenius peut également être utilisé en extrapolant la ligne jusqu’à l’ordonnée à l’origine pour obtenir le facteur pré-exponentiel, A. Ce facteur est important car A=p×Z, où p est un facteur stérique et Z est la fréquence de collision. Le facteur pré-exponentiel, ou fréquence, est lié au nombre de fois où les molécules se heurteront dans l’orientation nécessaire pour provoquer une réaction. Il est important de noter que l’équation d’Arrhenius est basée sur la théorie des collisions. Elle stipule que les particules doivent entrer en collision avec une orientation appropriée et avec suffisamment d’énergie. Maintenant que nous avons obtenu l’énergie d’activation et le facteur pré-exponentiel à partir du tracé d’Arrhenius, nous pouvons résoudre la constante de vitesse à n’importe quelle température en utilisant l’équation d’Arrhenius.
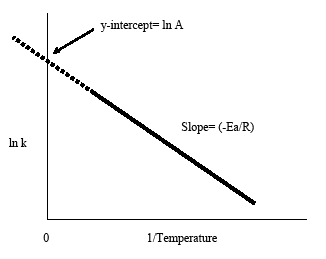
Le tracé d’Arrhenius est obtenu en traçant le logarithme de la constante de vitesse, k, en fonction de la température inverse, 1/T. La ligne à pente négative qui en résulte est utile pour trouver les composantes manquantes de l’équation d’Arrhenius. L’extrapolation de la ligne vers l’ordonnée à l’origine donne la valeur de ln A. La pente de la ligne est égale à l’énergie d’activation négative divisée par la constante des gaz, R. En règle générale, dans la plupart des réactions biologiques et chimiques, la vitesse de réaction double lorsque la température augmente tous les 10 degrés Celsius.
En regardant l’équation d’Arrhenius, le dénominateur de la fonction exponentielle contient la constante des gaz, R, et la température, T. Ce n’est le cas que lorsqu’on traite des moles d’une substance, car R a les unités de J/molK. Lorsqu’il s’agit de molécules d’une substance, la constante des gaz dans le dominateur de la fonction exponentielle de l’équation d’Arrhenius est remplacée par la constante de Boltzmann, kB. La constante de Boltzmann est exprimée en J/K. À température ambiante, kBT, est l’énergie disponible pour une molécule à 25 C ou 273K, et est égale à environ 200 nombres d’onde.
Il est important de noter que la décision d’utiliser la constante des gaz ou la constante de Boltzmann dans l’équation d’Arrhenius dépend principalement de l’annulation des unités. Pour prendre le logarithme inverse d’un nombre, ce nombre doit être sans unité. Par conséquent, toutes les unités du facteur exponentiel doivent s’annuler. Si l’énergie d’activation est exprimée en termes de joules par moles, la constante des gaz doit être utilisée dans le dominateur. Cependant, si l’énergie d’activation est en unité de joules par molécule, alors la constante, K, doit être utilisée.
- Équation d’Arrhenius par mole \
- Équation d’Arrhenius par molécule \
Équation d’Arrhenius « linéarisée »
L’équation d’Arrhenius (équation \ref{eq1}) peut être réarrangée pour traiter des situations spécifiques. Par exemple, en prenant le logarithme des deux côtés, on obtient l’équation ci-dessus sous la forme y=-mx+b.
On peut alors trouver un tracé de \(\ln k\) en fonction de \(1/T\) et de toutes les variables.
- (y=ln k\)
- (m=-Ea/RT\)
- (x=1/T\)
- (b=\ln A\)
Cette forme de l’équation d’Arrhenius permet de déterminer facilement la pente et l’ordonnée à l’origine à partir d’un tracé d’Arrhenius. Il est également pratique de noter que l’équation ci-dessus montre le lien entre la température et la constante de vitesse. Plus la température augmente, plus la constante de vitesse diminue, comme le montre le graphique. De ce lien, nous pouvons déduire que la constante de vitesse est inversement proportionnelle à la température.
Forme intégrée
La forme intégrée de l’équation d’Arrhenius est également utile (équation \ref{eq3}). Cette variation de l’équation d’Arrhenius implique l’utilisation de deux tracés d’Arrhenius construits sur le même graphique pour déterminer l’énergie d’activation. L’équation ci-dessus montre l’effet de la température sur plusieurs constantes de vitesse. Cela permet de déduire facilement la sensibilité des constantes de vitesse à l’énergie d’activation et aux changements de température. Si l’énergie d’activation est élevée pour une plage de température donnée, la constante de vitesse est très sensible ; les changements de température ont un effet significatif sur la constante de vitesse. Si l’énergie d’activation est faible pour une plage de température donnée, la constante de vitesse est moins sensible et les changements de température ont peu d’effet sur la constante de vitesse. Ce phénomène est illustré graphiquement dans l’exemple ci-dessous :
| 1/Temp | 0.0085 | 0,0075 | 0,0065 | 0,0055 | 0,0045 | 0,0035 | lnk (grand Ea) | 3 | 2,5 | 2 | 1,5 | 1 | 0.5 | lnk (petit Ea) | 1,8 | 1,7 | 1,6 | 1,5 | 1,4 | 1.3 |
|---|
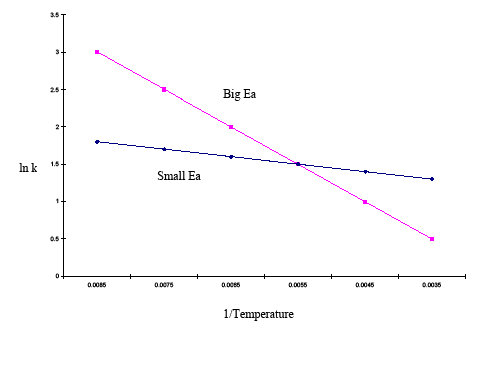
Le graphique ci-dessus montre que le tracé avec la pente la plus raide a une énergie d’activation plus élevée et que le tracé avec la pente la plus plate a une énergie d’activation plus petite. Cela signifie que sur une même plage de température, une réaction avec une énergie d’activation plus élevée évolue plus rapidement qu’une réaction avec une énergie d’activation plus faible.
Signification biologique
Le tracé d’Arrhenius peut devenir non linéaire si des étapes deviennent limitantes pour le taux à différentes températures. Un tel exemple peut être trouvé chez Fox et ses collaborateurs en 1972 avec le transport des bêta-glycosides dans E. coli. Les différences entre les températures de transition sont dues à la composition en acides gras des membranes cellulaires. La différence d’état de transition est le résultat du changement brutal de fluidité de la membrane. Un autre exemple comprend une chute soudaine à faible 1/T (températures élevées), résultat de la dénaturation des protéines.
Points clés
- Les tracés d’Arrhenius montrent que les vitesses de réaction sont inversement proportionnelles aux changements de température
- La pente négative du tracé d’Arrhenius donne l’énergie d’activation, Ea : pente = -Ea/R
- L’extrapolation du tracé d’Arrhenius vers l’ordonnée à l’origine donne lnA
- Le tracé d’Arrhenius montre comment l’énergie d’activation et la température affectent la sensibilité de la vitesse de réaction
Problèmes pratiques
1. T/F La Ea calculée à partir de l’équation d’Arrhenius donne une valeur exacte.
2. Décrire la relation entre la température et la Ea et donner des exemples.
3. En utilisant les informations suivantes :
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8,314 J mol/K
Calculez k à 27° C avec les unités appropriées.
4. En utilisant les informations du problème 3, calculez k à 37° C avec les unités appropriées.
5. En utilisant l’équation intégrée, résolvez Ea en utilisant :
k1=7,78×10-7 à T1=273 K
k2=3,46×10-5 à T2=298 K
Réponses
- Faux : Ea est une valeur moyenne ou » apparente « .
- Lorsque la température augmente, la constante de vitesse diminue lorsqu’on trace l’équation ci-dessus. Il en est de même lorsque la température diminue, la constante de vitesse augmente. De ce lien, la constante de vitesse est inversement proportionnelle à la température.
- k= 8,727 sec-1
- k=23,02 sec-1
- Ea=1.026×105 J/mol
Contributeurs et attributions
- David Johns et Andra Hutton (UC Davis)