Comment fonctionnent les tampons
Comme vous l’avez vu en calculant le pH des solutions, seule une petite quantité d’un acide fort est nécessaire pour modifier radicalement le pH. Pour certaines expériences, cependant, il est souhaitable de maintenir un pH relativement constant pendant que des acides ou des bases sont ajoutés à la solution, soit par réaction, soit par l’expérimentateur. Les chimistes utilisent couramment les tampons pour modérer le pH d’une réaction. La biologie trouve de multiples utilisations pour les tampons, qui vont du contrôle du pH du sang à la garantie que l’urine n’atteint pas des niveaux d’acidité douloureux.
Un tampon est simplement un mélange d’un acide faible et de sa base conjuguée ou d’une base faible et de son acide conjugué. Les tampons fonctionnent en réagissant avec toute orbase acide ajoutée pour contrôler le pH. Par exemple, considérons l’action d’un tampon composé d’une base faible, l’ammoniac, NH3, et de son acide conjugué, NH4+. Lorsque l’on ajoute du HCl à ce tampon, le NH3 « absorbe » le proton de l’acide pour devenir du NH4+. Comme ce proton est enfermé dans l’ion ammonium, il ne sert pas à augmenter significativement le pH de la solution.Lorsque NaOH est ajouté à ce même tampon, l’ion ammonium donne un proton à la base pour devenir de l’ammoniac et de l’eau.Ici, le tampon sert également à neutraliser la base.
Comme le montre l’exemple ci-dessus, un tampon fonctionne en remplaçant un acide fort ou une base forte par un acide faible. Le proton de l’acide fort est remplacé par l’ion ammonium, un acide faible. La base forte OH- est remplacée par la base faible ammoniac. Ces remplacements d’acides et de bases forts par des bases plus faibles donnent aux tampons leur extraordinaire capacité à modérer le pH.
Calcul du pH des solutions tamponnées
Les tampons doivent être choisis pour la gamme de pH appropriée qu’ils sont appelés à contrôler. La gamme de pH d’une solution tamponnée est donnée par l’équation de Henderson-Hasselbalch. Pour les besoins de la dérivation, nous allons imaginer un tampon composé d’un acide, HA, et de sa base conjuguée, A-. Nous savons que la constante de dissociation pKa de l’acide est donnée par cette expression :

L’équation peut être réarrangée comme suit :
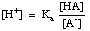
En prenant le -log de cette expression et en réarrangeant les termes pour que chacun soit positif, on obtient l’équation deHenderson-Hasselbalch :