Objectif d’apprentissage
1. Identifier les groupes fonctionnels aldéhyde, cétone, acide, ester et éther.
2. Utiliser les conventions de dénomination appropriées pour les molécules contenant des aldéhydes, des cétones, des acides carboxyliques, des esters et des éthers.
Il existe d’autres groupes fonctionnels qui contiennent des atomes d’oxygène. Un groupe carbonyle est formé lorsqu’un atome O et un atome C sont reliés par une double liaison. Dans ce schéma, le groupe R représente n’importe quelle chaîne hydrocarbonée :

Si une liaison du groupe carbonyle est faite à un atome d’hydrogène, alors la molécule est encore classée comme un aldéhyde. Pour nommer les aldéhydes, la chaîne principale d’atomes de carbone doit inclure le carbone du groupe carbonyle, qui est numéroté en position 1 dans la chaîne carbonée. Le nom d’origine de l’hydrocarbure est utilisé, mais le suffixe -al est ajouté. (Ne pas confondre -al avec -ol, qui est le suffixe utilisé pour les alcools.) Nous avons donc

Le méthanal a un nom commun avec lequel vous êtes peut-être familier : le formaldéhyde. La principale chose à noter à propos des aldéhydes est que le groupe carbonyle se trouve à l’extrémité d’une chaîne carbonée.
Un groupe carbonyle au milieu d’une chaîne carbonée implique que les deux liaisons restantes du groupe carbonyle sont faites à des atomes de C. Ce type de molécule est appelé une cétone. Malgré le fait que les aldéhydes et les cétones possèdent le même groupe carbonyle, ils ont des propriétés chimiques et physiques différentes et sont correctement regroupés comme deux types de composés différents. La plus petite cétone contient trois atomes de carbone. Pour nommer une cétone, on prend le nom de l’hydrocarbure parent et on change le suffixe en -one :
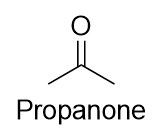
Le nom commun de la propanone est acétone. Avec les cétones plus grandes, nous devons utiliser un numéro de locus pour indiquer la position du groupe carbonyle juste avant le suffixe, comme nous l’avons fait avec les alcènes et les alcynes :
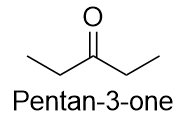
Il existe une façon non UICPA de nommer les cétones qui est également couramment utilisée : nommer les groupes alkyle qui sont attachés au groupe carbonyle et ajouter le mot cétone au nom. Ainsi, la propanone peut aussi être appelée diméthylcétone, tandis que la butan-2-one est appelée méthyléthylcétone.
Exemple 9
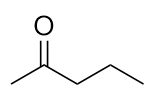
Dessinez la structure de la pentan-2-one.
Solution
Cette molécule possède cinq atomes de carbone en chaîne, avec le groupe carbonyle sur le deuxième atome de carbone. Sa structure est :
Test Yourself
Dessinez la structure de la méthyl butyl cétone.
Réponse

L’association d’un groupe fonctionnel carbonyle et d’un groupe hydroxyle donne le groupe carboxyle.

Les molécules possédant un groupe carboxyle sont appelées acides carboxyliques. Comme pour les aldéhydes, le groupe fonctionnel des acides carboxyliques se trouve à l’extrémité d’une chaîne carbonée. De même, comme pour les aldéhydes, l’atome de carbone du groupe fonctionnel est compté comme l’un des atomes de carbone qui définissent le nom de l’hydrocarbure parent. Pour nommer les acides carboxyliques, on utilise le nom parent de l’hydrocarbure, mais on ajoute le suffixe -acide oïque :

L’acide méthanoïque et l’acide éthanoïque sont aussi appelés respectivement acide formique et acide acétique. L’acide formique est le composé qui fait piquer certaines morsures de fourmis, tandis que l’acide acétique est la substance active du vinaigre.
Combien les acides carboxyliques sont-ils acides ? Il s’avère qu’ils ne sont pas très acides. Aucun acide carboxylique ne figure sur la liste des acides forts (tableau 12.2 » Acides forts et bases « ). (Pour plus d’informations sur les acides forts, voir la section 12.4 » Acides et bases forts et faibles et leurs sels « ). Cela signifie que tous les acides carboxyliques sont des acides faibles. Une solution 1 M d’acide formique n’est dissociée qu’à environ 1,3 % en ions H+ et en ions formiate, tandis qu’une solution similaire d’acide acétique n’est ionisée qu’à environ 0,4 %. Certains acides carboxyliques sont plus forts – par exemple, l’acide trichloracétique est dissocié à environ 45 % en solution aqueuse. Mais aucun acide carboxylique ne s’approche de la quantité de dissociation de 100 % requise par la définition d’un acide fort.
Comme leur nom l’indique, les acides carboxyliques agissent cependant comme des acides en présence de bases. L’atome H du groupe carboxyle se détache comme l’ion H+, laissant un ion carboxylate :

Les ions carboxylate sont nommés à partir du nom de l’acide : l’acide -oïque est remplacé par -oate pour nommer l’ion.
Exemple 10
Complétez la réaction chimique. Pouvez-vous nommer l’ion carboxylate formé ?

Solution
L’ion OH- élimine l’atome H qui fait partie du groupe carboxyle :

L’ion carboxylate, qui a la formule structurale condensée CH3CO2-, est l’ion éthanoate, mais il est communément appelé ion acétate.
Testez vous
Complétez la réaction chimique. Pouvez-vous nommer l’ion carboxylate formé ?

Réponse

L’ion est l’ion méthanoate, que l’on appelle communément l’ion formiate.
Une réaction à considérer est celle d’un acide carboxylique et d’un alcool. Lorsqu’ils sont combinés dans les conditions appropriées, une molécule d’eau sera retirée, et les morceaux restants se combineront pour former un nouveau groupe fonctionnel – le groupe ester :

Notez comment la molécule d’acide apporte un côté alkyle (représenté par R), tandis que l’alcool apporte l’autre côté (représenté par R′). Les esters sont nommés en utilisant le nom du groupe alkyle de l’alcool plus le nom du carboxylate de l’acide – par exemple, cette molécule est appelée propanoate de méthyle.

La chimie est partout : Esters, parfums et arômes
Les esters sont des composés très intéressants, en partie parce que beaucoup ont des odeurs et des saveurs agréables. (N’oubliez pas de ne jamais goûter quoi que ce soit dans le laboratoire de chimie !) De nombreux esters se produisent naturellement et contribuent au parfum des fleurs et au goût des fruits. D’autres esters sont synthétisés industriellement et sont ajoutés aux produits alimentaires pour en améliorer l’odeur ou le goût. Il est probable que si vous consommez un produit dont les ingrédients comprennent des arômes artificiels, ces arômes sont des esters. Voici quelques esters et leurs utilisations, grâce à leurs odeurs, leurs saveurs, ou les deux :
| Ester | Tastes/odeurs comme | Ester | Du goût/de l’odeur | |
|---|---|---|---|---|
| allyl hexanoate | ananas | formate d’isobutyle | framboise | |
| benzyl acétate | poire | acétate d’isobutyle | poire | |
| butanoate de butyle | ananas | méthyl phénylacétate | miel | |
| butanoate d’éthyle | banane | caprylate de nonyle | orange | |
| hexanoate d’éthyle | ananas | acétate de pentyle | pomme | |
| éthyl heptanoate | abricot | éthanoate de propyle | poire | |
| pentanoate d’éthyle | pomme | isobutyrate de propyle | rum |
Enfin, le groupe fonctionnel éther est un atome O qui est lié à deux groupes organiques :
R-O-R′
Les deux groupes R peuvent être identiques ou différents. Nommer les éthers est comme l’autre façon de nommer les cétones. Dans ce cas, les groupes R sont nommés séquentiellement, et le mot éther est accolé. La molécule CH3OCH3 est l’éther diméthylique, tandis que CH3OCH2CH3 est l’éther méthylique. L’éther diéthylique, un autre éther, était autrefois utilisé comme anesthésique, mais son inflammabilité et sa toxicité l’ont fait tomber en disgrâce. Les plus petites molécules d’éther qui sont liquides à température ambiante sont des solvants courants pour les réactions chimiques organiques.
Key Takeaways
- Les aldéhydes, les cétones, les acides carboxyliques, les esters et les éthers ont des groupes fonctionnels contenant de l’oxygène.
- La dénomination UICPA peut être utilisée pour les molécules contenant des aldéhydes, des cétones, des acides carboxyliques, des esters et des éthers.
Exercices
-
Nommer une similitude entre les groupes fonctionnels présents dans les aldéhydes et les cétones. Pouvez-vous nommer une différence entre eux ?
-
Expliquer comment un acide carboxylique est utilisé pour faire un ester.
-
Nommer chaque molécule.
a)
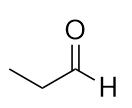
b)
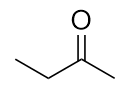
-
Nommer chaque molécule.
a)
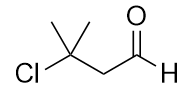
b)
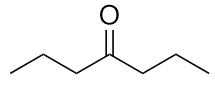
-
Nommer chaque molécule.
a)
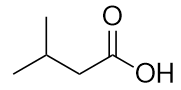
b)
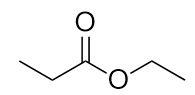
-
Nommez chaque molécule.
a)
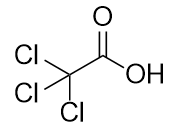
b)
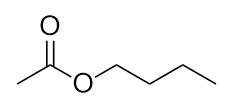
-
Nommer cette molécule.
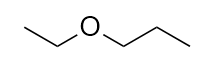
-
Nommez cette molécule.
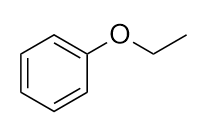
-
Donnez un nom alternatif mais acceptable à la molécule de l’exercice 3.2.
-
Donnez un autre nom, mais acceptable, à la molécule de l’exercice 4.2.
-
Complétez cette réaction chimique.
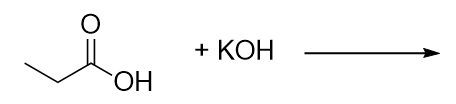
-
Complétez cette réaction chimique.
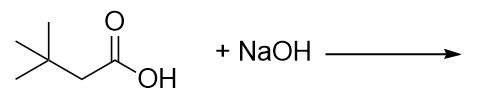
-
Le médicament connu sous le nom d’aspirine a cette structure moléculaire :
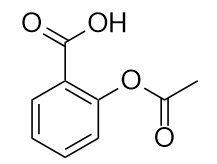
Identifiez le ou les groupes fonctionnels de cette molécule.
-
Le médicament connu sous le nom de naproxène sodique est le sel de sodium de cette molécule :
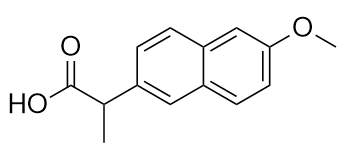
Identifiez le ou les groupes fonctionnels de cette molécule.
-
Identifiez l’ester fabriqué en faisant réagir ces molécules.
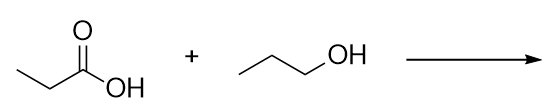
-
Identifiez l’ester fabriqué en faisant réagir ces molécules.
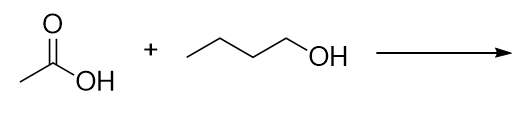
Réponses
1. Ils possèdent tous deux un groupe carbonyle, mais le groupe carbonyle d’un aldéhyde se trouve à l’extrémité d’une chaîne carbonée, tandis que le carbone carbonyle d’une cétone est entouré de deux autres carbones.
a) propanal
b) butan-2-one
a) acide 3-méthylbutanoïque
b) propionate d’éthyle
7. Éther éthylpropylique
9. Méthylcétone éthylique
11. H2O + KCH3CH2CO213. acide, ester et aromatique (cycle benzénique)
15. propionate de propyle
.