Propriétés des composés ioniques
Parce que tous les composés ioniques se forment lorsque les anions et les cations sont attirés les uns par les autres, les composés ioniques ont fréquemment des caractéristiques similaires.
Les composés ioniques forment des cristaux
Les composés ioniques sont constitués de cations et d’anions qui se collent les uns à côté des autres en raison de leurs charges opposées. Imaginez un seul cation lithium collé à côté d’un seul anion chlore pour former le chlorure de lithium. Il est peu probable qu’il n’y ait qu’un seul ion lithium et un seul ion chlorure à cet endroit ? En général, lorsque nous parlons de réactions chimiques, nous parlons d’un très grand nombre d’atomes qui subissent une réaction dans un endroit très petit (une cuillère à café de sel contient environ 1022 atomes). Par conséquent, si notre unique paire de LiCl devait se rapprocher d’une autre paire de LiCl, voici ce qui se passerait :
Parce que les ions de charge opposée s’attirent, les paires de LiCl auront tendance à former des groupes plus importants. Ces groupes plus importants formeront à leur tour des groupes d’ions encore plus importants, comme le montre la figure suivante :
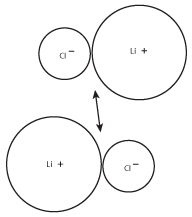
Figure 8.3La charge positive du cation lithium d’une paire sera attirée par la charge négative de l’ion chlorure de l’autre paire.

Figure 8.4Ce processus, où des empilements d’ions LiCl se combinent les uns aux autres, se poursuivra jusqu’à ce qu’il n’y ait plus d’ions lithium ou chlorure.
Les cristaux sont de grands arrangements d’ions ou d’atomes empilés selon des motifs réguliers. De nombreux composés ioniques forment de très grands cristaux.
Ces grands arrangements d’ions sont appelés des cristaux. Bien que les cristaux soient fréquemment formés à partir de composés ioniques, ils existent également dans certains autres composés chimiques, comme les diamants. Nous en parlerons plus en détail dans la section Solides.
Les hydrates se forment lorsqu’une ou plusieurs molécules d’eau se fixent sur des composés ioniques. Ces composés sont intéressants car ils semblent secs mais dégagent de l’eau lorsqu’ils sont chauffés. Le sel d’Epsom, ou sulfate de magnésium heptahydraté (MgSO47H2O), est particulièrement intéressant. Lorsqu’il est chauffé, il dégage suffisamment d’eau pour dissoudre réellement le sulfate de magnésium !
Les composés ioniques ont souvent des points de fusion et d’ébullition élevés
Que se passe-t-il lorsque vous chauffez quelque chose dans votre cuisine ? Vous avez peut-être découvert en cuisinant (ou en passant au micro-ondes des choses au hasard en vous ennuyant) que la plupart des aliments que nous mangeons fondent ou brûlent lorsqu’ils sont chauffés. Certains aliments font même les deux ! Comme vous pouvez probablement le deviner, je suis un expert lorsqu’il s’agit d’éteindre des incendies domestiques.
Les composés ioniques, en revanche, fondent et bouillissent fréquemment à des températures beaucoup plus élevées que les autres matériaux. Pour que les composés ioniques fondent, il faut ajouter suffisamment d’énergie pour que les cations et les anions s’éloignent les uns des autres. Comme ces attractions sont très fortes, il faut beaucoup d’énergie pour séparer ces ions. Ajouter cette quantité d’énergie aux composés ioniques nécessite une grande quantité de chaleur, c’est pourquoi les composés ioniques ont des points de fusion et d’ébullition très élevés.
Les composés ioniques sont durs et cassants
Imaginez vous frapper un gros morceau de chlorure de lithium contre votre tête. Quelle sensation pensez-vous que cela puisse procurer ? Si vous avez deviné que cela ferait un mal de chien, vous aviez raison. Comme de nombreux composés ioniques, le chlorure de lithium est aussi dur qu’une pierre.
Les composés ioniques sont extrêmement durs car il est difficile de faire en sorte que les ions s’éloignent les uns des autres dans un cristal. Même si vous appliquez une grande force sur le cristal (imaginez que vous foncez tête baissée dans un mur géant de chlorure de lithium), l’attraction entre les cations et les anions continuera fréquemment à maintenir le cristal ensemble.
Disons, cependant, que vous voulez vraiment briser un composé ionique. Bien que très durs, les composés ioniques sont aussi fréquemment très fragiles, ce qui signifie qu’ils se brisent lorsque le bon type de force est appliqué. Comme le montre la figure suivante, l’endroit où vous appliquez la force est tout aussi important que la quantité de force que vous utilisez.

Figure 8.5En appliquant une force de manière à prier les cations et les anions les uns des autres : vous pouvez provoquer la rupture complète d’un cristal.
Comme vous pouvez le voir sur ce diagramme, les cristaux ioniques s’alignent de telle sorte qu’il existe des régions où une petite force peut briser le cristal. Ces régions sont parfois appelées » plans de clivage » car ce sont les endroits où le cristal est le plus faible et peut être le plus facilement brisé.
Les composés ioniques conduisent l’électricité lorsqu’ils sont dissous dans l’eau ou fondus
Il était une fois un inventeur qui a imaginé un appareil pour sécher les cheveux. Ce « sèche-cheveux », comme il l’appelait, chauffait de l’air avec de l’électricité et le soufflait sur les cheveux de la personne qui le tenait. Comme l’eau s’évapore lorsqu’elle est chauffée, les cheveux séchaient plus rapidement. L’héritage de cet inventeur perdure encore aujourd’hui dans un appareil ménager aimé par des millions de personnes.
Les électrolytes sont des composés qui conduisent l’électricité lorsqu’ils sont dissous dans l’eau. De nombreux composés ioniques sont considérés comme des électrolytes. Cependant, certains composés ioniques ne se dissolvent pas dans l’eau. Par conséquent, ils ne partagent pas cette propriété.
Peu après, il y avait un gars qui a décidé qu’il ne voulait pas attendre de sortir de la baignoire avant de se sécher les cheveux. Son héritage : Un autocollant d’avertissement de sèche-cheveux avec la photo d’un type qui se fait électrocuter.
Lorsque des composés ioniques sont placés dans l’eau, ils font en sorte que l’eau conduise l’électricité. Normalement, l’eau ne conduit pas bien du tout l’électricité. Cependant, lorsque les sels se dissolvent dans l’eau, ils se décomposent en leurs cations et anions constitutifs et c’est la présence de ces ions qui lui permet de conduire l’électricité. Comme les sels conduisent l’électricité lorsqu’ils sont dissous dans l’eau, on les appelle des électrolytes.
De la même manière, les sels purs conduisent également l’électricité lorsqu’ils sont fondus. À l’état solide, les anions et les cations d’un composé ionique sont verrouillés en place et incapables de déplacer une charge électrique. Cependant, lorsque le composé ionique est fondu, ces ions sont libres de se déplacer et de conduire la charge.
Excerté de The Complete Idiot’s Guide to Chemistry 2003 par Ian Guch. Tous droits réservés, y compris le droit de reproduction en tout ou en partie sous quelque forme que ce soit. Utilisé par arrangement avec Alpha Books, un membre de Penguin Group (USA) Inc.
Pour commander ce livre directement auprès de l’éditeur, visitez le site Web de Penguin USA ou appelez le 1-800-253-6476. Vous pouvez également acheter ce livre sur Amazon.com et Barnes & Noble.
.