Faits, résumé & Définition
- Les enzymes allostériques sont des enzymes qui ont un site supplémentaire auquel un effecteur peut se lier, en plus du site actif
- Les effecteurs régulent l’activité de l’enzyme – ils peuvent soit activer soit inhiber
- Les enzymes allostériques sont plus grandes et plus complexes que les enzymes normales
- Elles sont régulées par une régulation homotrope ou une régulation hétérotrope
Que sont les enzymes allostériques ?
Vous vous souvenez que les enzymes sont classées comme des catalyseurs biologiques. C’est-à-dire qu’elles aident à accélérer la vitesse d’une réaction, mais restent inchangées pendant tout le processus.
Les enzymes allostériques sont des enzymes qui possèdent un site supplémentaire, en plus du site actif – cela vient du grec » allo « , qui signifie » autre « . Ces sites sont appelés sites allostériques, et les enzymes peuvent en avoir plus d’un. Ils sont uniques en ce sens qu’ils ont la capacité de répondre à de multiples conditions différentes dans leur environnement immédiat. De plus, lorsque les enzymes allostériques sont représentées sur un graphique sous forme de vitesse en fonction de la concentration en substrat, elles présentent une courbe sigmoïde plutôt que la courbe hyperparabolique habituelle.
L’image ci-dessous montre une enzyme allostérique générique.

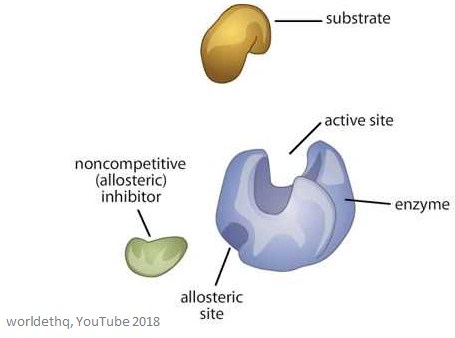
Propriétés des enzymes allostériques
Les sites allostériques sont des sites de liaison sur l’enzyme – ils sont différents du site actif et du site de liaison du substrat.
La molécule qui se lie au site allostérique est appelée effecteur (elle peut aussi être appelée modulateur), et elle régule l’activité de l’enzyme à laquelle elle se lie.
L’activité de l’enzyme est augmentée lorsqu’un effecteur allostérique positif se lie au site allostérique. Cela signifie que l’activité de l’enzyme est diminuée lorsqu’un effecteur allostérique négatif se lie au site allostérique – ils inhibent l’enzyme.
Les enzymes allostériques sont plus grandes et plus complexes que les enzymes non allostériques et ont souvent de nombreuses sous-unités. Les enzymes ayant plus d’un effecteur ont des sites de liaison différents et spécifiques pour chacun d’eux. Dans la plupart des enzymes allostériques, le site de liaison du substrat et le site de liaison de l’effecteur se trouvent sur des sous-unités différentes.
Le site de liaison du substrat se trouve sur la sous-unité catalytique – souvent appelée sous-unité C. Le site de liaison de l’effecteur se trouve sur la sous-unité régulatrice – souvent appelée sous-unité R.
Lorsqu’une molécule effectrice sur un site de liaison provoque un changement de conformation de cette sous-unité, un changement de conformation est ensuite provoqué dans les autres sous-unités de la protéine – cela signifie qu’une énorme partie de l’énergie de liaison de l’effecteur est utilisée pour changer la conformation de l’ensemble du complexe protéique.
Cette interaction entre toutes les sous-unités peut être exprimée à l’aide du coefficient de Hill – on l’appelle aussi coefficient de coopérativité. Lorsque n=1, il n’y aura aucune interaction entre les sous-unités de l’enzyme. Plus le coefficient de Hill (coefficient de coopérativité) est grand, plus les interactions entre toutes les sous-unités de l’enzyme sont fortes.
Les enzymes allostériques peuvent également » commuter » entre leur forme active et leur forme inactive. Cela permet des modèles de réponse sophistiqués dans l’activité, qui peuvent jouer un rôle énorme dans la fonction biologique. Une fois que l’effecteur se dissocie du site de liaison, l’enzyme est alors capable de revenir à sa forme inactive (ou moins active). Ils peuvent contrôler les taux de réactions très importantes, comme la production d’ATP.
Lorsqu’un effecteur se lie à une enzyme, on parle de liaison coopérative.
Régulation homotrope
Un effecteur allostérique homotrope est un substrat pour l’enzyme, ainsi qu’une molécule régulatrice – le préfixe » homo » indique qu’il s’agit de la même chose. Ils sont généralement des activateurs de l’enzyme. L’image ci-dessous montre un effecteur allostérique homotrope.

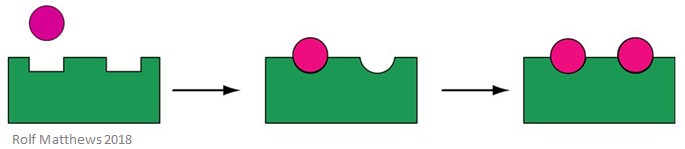
Un bon exemple d’effecteur allostérique homotrope est l’oxygène (O2) – il agit comme effecteur de l’hémoglobine dans le corps humain.
Régulation hétérotrope
Un effecteur allostérique hétérotrope est une molécule régulatrice qui n’est pas également le substrat de l’enzyme. Elle peut soit activer, soit inhiber l’enzyme à laquelle elle se lie. L’image ci-dessous montre un effecteur allostérique hétérotrope.

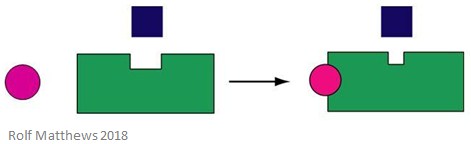
Un bon exemple d’effecteur allostérique hétérotrope est le dioxyde de carbone (CO2) – il agit également comme effecteur de l’hémoglobine mais n’est pas le substrat de l’enzyme.
Les activateurs essentiels
Les activateurs essentiels sont des activateurs allostériques qui, sans eux, l’activité de l’enzyme serait si faible qu’elle serait négligeable. Par exemple, le N-acétylglutamate est un activateur essentiel de la carbamoyl phosphate synthétase I. Ils sont l’exact opposé des inhibiteurs d’enzymes.
Les activateurs essentiels sont des activateurs allostériques qui, sans eux, l’activité de l’enzyme serait si faible qu’elle en serait négligeable.