En 1889, Svante Arrhenius propuso la ecuación de Arrhenius a partir de sus observaciones directas de las parcelas de constantes de velocidad frente a las temperaturas:
La energía de activación, Ea, es la energía mínima que deben poseer las moléculas para reaccionar y formar un producto. La pendiente de la gráfica de Arrhenius puede utilizarse para encontrar la energía de activación. El gráfico de Arrhenius también puede utilizarse extrapolando la línea hasta la intersección y para obtener el factor preexponencial, A. Este factor es importante porque A=p×Z, donde p es un factor estérico y Z es la frecuencia de colisión. El factor preexponencial, o de frecuencia, está relacionado con la cantidad de veces que las moléculas chocarán en la orientación necesaria para provocar una reacción. Es importante señalar que la ecuación de Arrhenius se basa en la teoría de las colisiones. Ésta establece que las partículas deben chocar con la orientación adecuada y con la energía suficiente. Ahora que hemos obtenido la energía de activación y el factor preexponencial a partir del gráfico de Arrhenius, podemos resolver la constante de velocidad a cualquier temperatura utilizando la ecuación de Arrhenius.
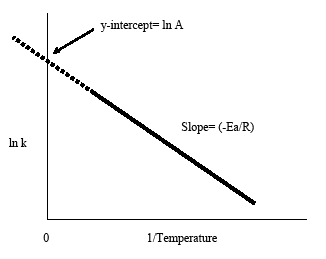
El gráfico de Arrhenius se obtiene trazando el logaritmo de la constante de velocidad, k, frente a la temperatura inversa, 1/T. La línea resultante de pendiente negativa es útil para encontrar los componentes que faltan en la ecuación de Arrhenius. La extrapolación de la línea de vuelta a la intersección y arroja el valor de ln A. La pendiente de la línea es igual a la energía de activación negativa dividida por la constante de los gases, R. Como regla general en la mayoría de las reacciones biológicas y químicas, la velocidad de reacción se duplica cuando la temperatura aumenta cada 10 grados Celsius.
Al observar la ecuación de Arrhenius, el denominador de la función exponencial contiene la constante de los gases, R, y la temperatura, T. Esto sólo ocurre cuando se trata de moles de una sustancia, porque R tiene las unidades de J/molK. Cuando se trata de moléculas de una sustancia, la constante de los gases en el dominador de la función exponencial de la ecuación de Arrhenius se sustituye por la constante de Boltzmann, kB. La constante de Boltzmann tiene las unidades J/K. A temperatura ambiente, kBT, es la energía disponible para una molécula a 25 C o 273K, y es igual a aproximadamente 200 números de onda.
Es importante señalar que la decisión de utilizar la constante de gas o la constante de Boltzmann en la ecuación de Arrhenius depende principalmente de la cancelación de las unidades. Para tomar el logaritmo inverso de un número, éste debe carecer de unidades. Por lo tanto, todas las unidades en el factor exponencial deben cancelarse. Si la energía de activación está en términos de julios por moles, entonces se debe utilizar la constante de los gases en el dominador. Sin embargo, si la energía de activación está en unidad de julios por molécula, entonces se debe utilizar la constante, K.
- Ecuación de Arrhenius por mol |/li>
- Ecuación de Arrhenius por molécula |/li>
Ecuación de Arrhenius «linealizada»
La ecuación de Arrhenius (Ecuación |ref{eq1}) puede reordenarse para tratar situaciones específicas. Por ejemplo, si se toma el logaritmo de ambos lados se obtiene la ecuación anterior en la forma y=-mx+b.
Entonces, se puede encontrar un gráfico de \N(\ln k\) frente a \N(1/T\) y todas las variables.
- (y=ln k\)
- (m=-Ea/RT\)
- (x=1/T\)
- (b=ln A\)
- Las gráficas de Arrhenius muestran que las velocidades de reacción son inversamente proporcionales a los cambios de temperatura
- La pendiente negativa de la gráfica de Arrhenius da la energía de activación, Ea: pendiente = -Ea/R
- La extrapolación del gráfico de Arrhenius de vuelta a la intersección y da lnA
- El gráfico de Arrhenius muestra cómo la energía de activación y la temperatura afectan a la sensibilidad de la velocidad de reacción
- Falso: Ea es un valor medio o «aparente».
- A medida que aumenta la temperatura, la constante de velocidad disminuye cuando se representa la ecuación anterior. Lo mismo ocurre cuando la temperatura disminuye, la constante de velocidad aumenta. De esta conexión, la constante de velocidad es inversamente proporcional a la temperatura.
- k= 8,727 seg-1
- k=23,02 seg-1
- Ea=1.026×105 J/mol
- David Johns y Andra Hutton (UC Davis)
Esta forma de la ecuación de Arrhenius hace que sea fácil determinar la pendiente y la intersección de y a partir de un gráfico de Arrhenius. También es conveniente observar que la ecuación anterior muestra la conexión entre la temperatura y la constante de velocidad. A medida que la temperatura aumenta, la constante de velocidad disminuye según el gráfico. De esta conexión podemos deducir que la constante de velocidad es inversamente proporcional a la temperatura.
Forma integrada
La forma integrada de la ecuación de Arrhenius también es útil (Ecuación \ref{eq3}). Esta variación de la ecuación de Arrhenius implica el uso de dos gráficos de Arrhenius construidos en la misma gráfica para determinar la energía de activación. La ecuación anterior, muestra el efecto de la temperatura en múltiples constantes de velocidad. Esto permite inferir fácilmente la sensibilidad de las constantes de velocidad a la energía de activación y a los cambios de temperatura. Si la energía de activación es alta para un rango de temperatura dado, entonces la constante de velocidad es muy sensible; los cambios de temperatura tienen un efecto significativo en la constante de velocidad. Si la energía de activación es baja para un rango de temperatura dado, entonces la constante de velocidad es menos sensible, y los cambios de temperatura tienen poco efecto sobre la constante de velocidad. Este fenómeno se ilustra gráficamente en el siguiente ejemplo:
| 1/Temp | 0.0085 | 0,0075 | 0,0065 | 0,0055 | 0,0045 | 0,0035 | lnk (large Ea) | 3 | 2,5 | 2 | 1,5 | 0.5 |
|---|---|---|---|---|---|---|
| lnk (Ea pequeño) | 1,8 | 1,7 | 1,6 | 1,5 | 1,4 | 1.3 |
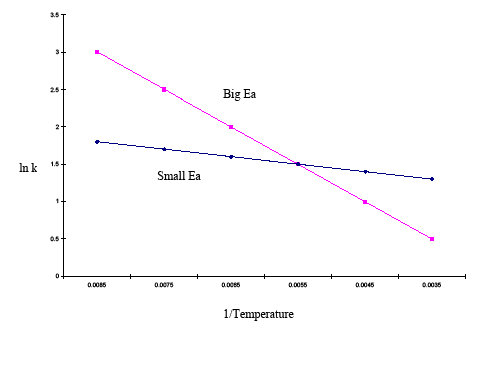
El gráfico anterior muestra que la parcela con la pendiente más pronunciada tiene una energía de activación mayor y la parcela con la pendiente más plana tiene una energía de activación menor. Esto significa que en el mismo rango de temperatura, una reacción con una energía de activación más alta cambia más rápidamente que una reacción con una energía de activación más baja.
El gráfico de Arrhenius puede convertirse en no lineal si los pasos se convierten en limitantes de la velocidad a diferentes temperaturas. Un ejemplo de ello lo encontramos con Fox y colaboradores en 1972 con el transporte de beta-glicósidos en E. coli. Las diferencias en las temperaturas de transición se deben a la composición de ácidos grasos en las membranas celulares. La diferencia del estado de transición es el resultado del cambio brusco de la fluidez de la membrana. Otro ejemplo incluye una caída repentina a bajas 1/T (altas temperaturas), resultado de la desnaturalización de las proteínas.
Puntos clave
1. T/F La Ea calculada a partir de la ecuación de Arrhenius da un valor exacto.
2. Describa la relación entre la temperatura y la Ea y dé ejemplos.
3. Utilizando la siguiente información:
A= 1×1014seg-1
Ea= 75×103 J/mol
R= 8,314 J mol/K
Calcule k a 27° C con las unidades adecuadas.
4. Utilizando la información del problema 3, calcule k a 37° C con las unidades adecuadas.
5. Utilizando la ecuación integrada resuelva Ea utilizando:
k1=7,78×10-7 a T1=273 K
k2=3,46×10-5 a T2=298 K