US Pharm. 2017;42(12):HS2-HS6.
ABSTRACT: La diarrea suele ser el síntoma revelador en los pacientes que sufren el síndrome carcinoide secundario a un tumor carcinoide. Se cree que la etiología de esta gravosa diarrea es la hipersecreción de serotonina de las células neuroendocrinas. El diagnóstico se basa en los síntomas clínicos y en dos biomarcadores, el ácido 5-hidroxiindolacético (que se encuentra en la orina) y la cromogranina A (que se encuentra en el suero). Los análogos sintéticos de la somatostatina (SSA) han sido un elemento básico del tratamiento durante años y siguen utilizándose. Telotristat es el primer medicamento oral indicado en combinación con ASE para pacientes con diarrea por síndrome carcinoide que ya no responden a los ASE solos.
Los tumores neuroendocrinos (TNE) abarcan una amplia variedad de tumores de crecimiento lento. La incidencia en Estados Unidos oscila entre dos y cinco por cada 100.000 pacientes y parece estar aumentando, probablemente debido a la mejora de las técnicas de cribado.1 Aunque estos tumores son generalmente asintomáticos, es más probable que se desarrollen síntomas cuando un tumor hace metástasis en el hígado o el pulmón o si el tumor primario se origina en el intestino medio -es decir, intestino delgado, apéndice o intestino grueso proximal.2,3
Tumores carcinoides y síndrome carcinoide
Los tumores carcinoides son NETs que surgen principalmente de las células enterocromafines localizadas en todo el tracto gastrointestinal (GI) y bronquial.1,2 Estas células son responsables de la producción, el almacenamiento y la secreción de muchas sustancias biológicamente activas, como la serotonina, la norepinefrina, la dopamina, la histamina, la bradiquinina, las prostaglandinas y la sustancia P, entre otras, que pueden conducir al desarrollo del síndrome carcinoide, un término colectivo que engloba una serie de síntomas mediados por las hormonas secretadas por el tumor carcinoide.1-4
Una NET bien diferenciada expresa numerosos receptores de somatostatina (SSTR).1 De los cinco tipos de SSTR, los SSTR1 y SSTR5 son el objetivo de los análogos sintéticos de la somatostatina (SSA). Los tumores carcinoides sobreexcretan serotonina, que agota el triptófano endógeno. Una célula normal convierte sólo el 1% del triptófano en serotonina, mientras que una célula de un tumor carcinoide produce serotonina hasta que se agotan las reservas de triptófano.3 El triptófano es un precursor de la niacina, que es un componente esencial de la nicotinamida y de la nicotinamida adenina dinucleótido/nicotinamida adenina dinucleótido fosfato, así como de la síntesis de proteínas.3
Los síntomas más comunes del síndrome carcinoide son rubor, diarrea, taquicardia, broncoespasmo y dificultad para respirar. También puede producirse inestabilidad hemodinámica, aunque es poco frecuente con las terapias actuales.5 Los pacientes con síndrome carcinoide no controlado a largo plazo pueden desarrollar pelagra, lesiones valvulares cardíacas, telangiectasia venosa y/o broncoespasmo.2 Menos del 10% de los pacientes con tumores carcinoides GI desarrollan síndrome carcinoide, y la mayoría de los que lo hacen tienen metástasis hepáticas.2
Diarrea del síndrome carcinoide
La diarrea se produce en el 80% de los pacientes con síndrome carcinoide.6 Los pacientes con diarrea del síndrome carcinoide experimentan deposiciones explosivas, acuosas y sueltas varias veces al día, lo que puede ser una carga para el paciente y un reto para el profesional sanitario. Un estudio de cohortes descubrió que los costes sanitarios son 1,5 veces más altos y el riesgo de hospitalización es dos veces mayor en los pacientes con diarrea por síndrome carcinoide que en los que no tienen diarrea.7 La fisiopatología de la diarrea por síndrome carcinoide implica la presencia de un exceso de serotonina, que estimula la secreción de moco colónico, aumenta el peristaltismo e inhibe la absorción en el tracto gastrointestinal, todo lo cual conduce a la diarrea.3,4,6 En comparación con los pacientes sanos, el tiempo de tránsito del colon proximal puede ser hasta seis veces más rápido y el tiempo de tránsito del intestino delgado puede ser dos veces más rápido en los pacientes con diarrea por síndrome carcinoide.6
Factores de riesgo
Se cree que los NET se desarrollan de forma esporádica o en individuos genéticamente predispuestos.3 Cuando un familiar de primer grado tiene un TNE, la probabilidad de desarrollar un TNE es de 12,5 por cada 100.000 personas y 15,7 por cada 100.000 personas para hombres y mujeres, respectivamente.7 Otras afecciones asociadas, de las que se informó en una revisión retrospectiva de 36 pacientes con diarrea por síndrome carcinoide, incluyen gastritis atrófica (67%), anemia perniciosa (58%), hipotiroidismo (39%), diabetes (19%), insuficiencia corticosuprarrenal (6%) e hiperparatiroidismo (6%).8 Según una investigación prospectiva de 494.000 sujetos inscritos en el estudio NIH-AARP Diet and Health Study que fueron seguidos durante 8 años, la ingesta de grasas saturadas se asocia con un mayor riesgo de desarrollar tumores carcinoides.9 La ingesta de carne y grasa se estimó a partir de cuestionarios de frecuencia de alimentos. El riesgo de tumores carcinoides del intestino delgado se asoció a una ingesta elevada de grasas saturadas en comparación con una ingesta baja de grasas saturadas (cociente de riesgos 3,18; IC del 95%, 1,62-6,25).9 Una vez que un paciente tiene diarrea por síndrome carcinoide, la dieta y el estrés pueden afectar a los síntomas. Los pacientes deben evitar los factores precipitantes, como los alimentos que contienen tirosina (queso curado, carne y pescado fermentados, alimentos en escabeche, tofu, chocolate), el alcohol y el aumento de catecolaminas (ejercicio, esfuerzo).1,2
Diagnóstico
El diagnóstico de la diarrea del síndrome carcinoide se basa en los síntomas de diarrea y enrojecimiento combinados con los hallazgos objetivos del tumor carcinoide a través de la biopsia, el TAC abdominal/pélvico multifásico, la RMN o los biomarcadores.10 Los biomarcadores ácido 5-hidroxiindolacético (5-HIAA; se encuentra en la orina) y cromogranina A (CgA; se encuentra en el suero) tienen una especificidad y sensibilidad aceptables para los tumores carcinoides.10,11 La serotonina es metabolizada por la monoaminooxidasa a 5-HIAA, y la CgA se libera de las paredes de las vesículas que almacenan serotonina. Los niveles normales de 5-HIAA en orina oscilan entre 3 y 15 mg/24 h; un nivel elevado tiene una especificidad del 100% y una sensibilidad del 73% para los tumores carcinoides.11 Los niveles de CgA en suero tienden a correlacionarse con el volumen del tumor, pero no con los síntomas. Los niveles de CgA superiores a 130 mcg/L se asocian con una especificidad del 98,4% y una sensibilidad del 62,9% para los tumores carcinoides.11 Los pacientes deben evitar los alimentos ricos en serotonina 48 horas antes de la recogida de orina. Los niveles de 5-HIAA en orina pueden ser falsamente reducidos por la levodopa, mientras que los niveles de CgA en suero pueden ser falsamente elevados por los inhibidores de la bomba de protones, la insuficiencia renal o las condiciones inflamatorias.10-13
Tratamiento
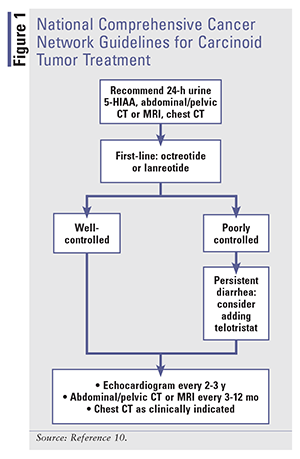
Las modalidades de tratamiento para la diarrea del síndrome carcinoide se centran en mejorar los síntomas y modificar la enfermedad en sí misma, como se evidencia por la normalización de los biomarcadores.11 Los SSA son el pilar de la terapia para los tumores carcinoides. La somatostatina influye en varias funciones gastrointestinales, como la motilidad gastrointestinal, la secreción de hormonas pancreáticas e intestinales y la secreción de bilis y fluidos colónicos.13 Cuando se une a los receptores, la somatostatina inhibe la secreción de mediadores biológicos, lo que mejora drásticamente el enrojecimiento y la diarrea al reducir la serotonina, como se demuestra por la reducción de 5-HIAA en orina.13 También se observa una regresión del tumor con los SSA.12,14,15 Véase la FIGURA 1 para las directrices de la National Comprehensive Cancer Network (NCCN) para el tratamiento de los tumores carcinoides.
Análogos de la somatostatina: Los SSA octreotida y lanreotida proporcionan control hormonal en pacientes con tumores carcinoides.16,17 La octreotida de acción corta (SA) fue el primer SSA aprobado para el control de los síntomas asociados a los tumores carcinoides.16,18 Desafortunadamente, con una vida media de 2 horas, es necesario repetir la dosis. La octreotida de liberación prolongada (LA) proporciona niveles sostenidos del fármaco y se administra mensualmente por vía IM.15 Los estudios que comparan las formulaciones SA y LA han demostrado una eficacia similar en cuanto al control de los síntomas, con tasas de respuesta del 60% al 72%.18
La lanreotida está disponible como formulación de liberación prolongada (Somatuline Depot) administrada mediante inyección profunda SC cada 4 semanas.17,18 La octreotida SA y la lanreotida LA tienen una eficacia similar en el alivio de los síntomas.16 Se realizó un ensayo clínico de fase III para evaluar el uso de octreotida SA SC para controlar los síntomas asociados al síndrome carcinoide en pacientes que recibieron lanreotida 120 mg SC (n = 59) o placebo (n = 56) cada 4 semanas durante 16 semanas.19 El porcentaje de días con octreotida como medicación de rescate fue significativamente menor en los pacientes con lanreotida (33,7%; IC del 95%, 25%-42,4%) que en los pacientes con placebo (48,5%; IC del 95%, 39,6%-57,4%, P = 0,016).
Pasireotida (Signifor) se une a SSTR1 y SSTR5 con mayor afinidad que octreotida y lanreotida.16 En un ensayo clínico de fase II, demostró su eficacia en pacientes con NETs avanzados y síndrome carcinoide que ya no respondían a la octreotida.20 La pasireotida de liberación prolongada (LAR), que está aprobada por la FDA solo para la acromegalia y el síndrome de Cushing, mostró una eficacia similar en el control de los síntomas del síndrome carcinoide en comparación con la octreotida LAR de dosis alta y dio lugar a una mejor supervivencia libre de progresión en pacientes refractarios a los SA en un estudio de fase III de 2015.21,22
Cuando el objetivo es el control de los síntomas, la terapia comienza con octreotida SA. Dado que las preparaciones de LA pueden tardar hasta 3 semanas en alcanzar los niveles de estado estable, el control de los síntomas puede gestionarse con octreotida SA.15,18 La dosis se inicia a un nivel bajo (100-600 mcg diarios en 2-4 dosis) y se titula hasta la dosis efectiva más baja necesaria para controlar los síntomas. La octreotida LA se inicia con 20 mg IM por vía intraglútea cada 4 semanas, y la octreotida SA se administra de forma concomitante durante al menos 2 semanas. Véase la TABLA 1 para conocer la dosis, los efectos adversos y las posibles interacciones medicamentosas.
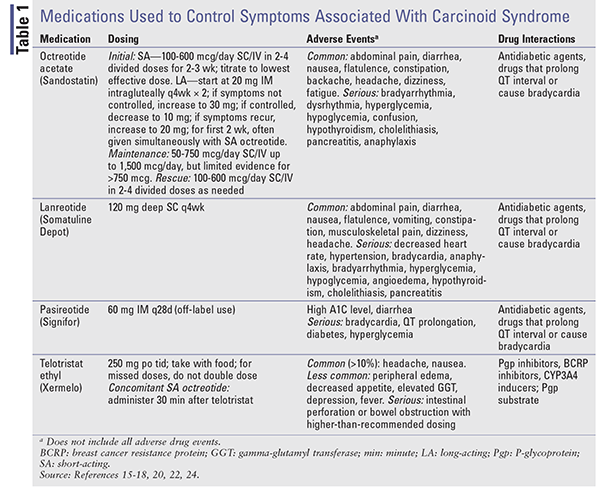
Telotristat etilo: El telotristat etilo (Xermelo), que es un profármaco del telotristat, inhibe la enzima triptófano hidroxilasa, lo que provoca una disminución de la serotonina periférica. Está aprobado por la FDA para el tratamiento de la diarrea del síndrome carcinoide en combinación con la terapia de SSA en pacientes inadecuadamente controlados con la terapia de SSA sola.23,24 Se llevó a cabo un estudio prospectivo y aleatorizado de fase III en el que 135 pacientes que experimentaban cuatro o más deposiciones diarias a pesar de la dosis estable de ASS recibieron telotristat 250 mg tres veces al día, telotristat 500 mg tres veces al día o placebo durante 12 semanas.25 Las reducciones medias de la frecuencia diaria de deposiciones para el placebo, telotristat 250 mg y telotristat 500 mg fueron de -0,9, -1,7 y -2,1, respectivamente. Telotristat es costoso, con un precio medio al por mayor de 6.196,80 dólares por ochenta y cuatro comprimidos de 250 mg.23
Otros agentes: La diarrea del síndrome carcinoide se trata con ASS, y se añade telotristat cuando los síntomas siguen sin controlarse. Una respuesta positiva a los agentes quimioterapéuticos que tratan la NET subyacente, reduciendo así la actividad del tumor, puede aliviar los síntomas del síndrome carcinoide. La revisión de estos agentes quimioterapéuticos está fuera del alcance de este artículo. Si la enfermedad progresa tras el uso de octreotida o lanreotida, la NCCN recomienda el uso de everolimus; interferón alfa-2b; o los agentes quimioterapéuticos citotóxicos 5-fluorouracilo, capecitabina, dacarbazina, oxaliplatino, estreptozocina o temozolomida para los NET no resecables y/o metastásicos del tracto GI.10
Conclusión
La incidencia de los tumores carcinoides, un tipo de NET, está aumentando. No se conocen factores de riesgo para el desarrollo de NETs ni factores que puedan identificar qué pacientes desarrollarán el síndrome carcinoide, aunque la mayoría de los pacientes con síndrome carcinoide suelen tener metástasis hepáticas al inicio. El síndrome carcinoide describe un grupo de síntomas mediados por varias hormonas liberadas por un tumor carcinoide. No todos los pacientes con tumores carcinoides experimentan el síndrome carcinoide. La diarrea del síndrome carcinoide puede ser explosiva y producirse varias veces al día. Los ASE son el pilar de la terapia para el alivio sintomático de la diarrea secundaria a los tumores carcinoides, y las nuevas terapias, como el telotristat añadido a la terapia con ASE, proporcionan opciones para los pacientes cuyos síntomas son insoportables.
1. Cives M, Soares HP, Strosberg J. ¿Impactará la heterogeneidad clínica de los tumores neuroendocrinos en su manejo en el futuro? Lecciones de ensayos recientes. Curr Opin Oncol. 2016;28:359-366.
2. Robertson RG, Geiger WJ, Davis NB. Tumores carcinoides. Am Fam Physician. 2006;74:429-434.
3. Lips CJ, Lentjes EG, Höppener JW. The spectrum of carcinoid tumours and carcinoid syndromes. Ann Clin Biochem. 2003;40:612-627.
4. Bertrand PP, Bertrand RL. Liberación y captación de serotonina en el tracto gastrointestinal. Auton Neurosci. 2010;153:47-57.
5. Yao JC, Hassan M, Phan A, et al. Cien años después del «carcinoide»: epidemiología y factores pronósticos de los tumores neuroendocrinos en 35.825 casos en los Estados Unidos. J Clin Oncol. 2008;26:3063-3072.
6. von der Ohe MR, Camilleri M, Kvols LK, Thomforde GM. Disfunción motora del intestino delgado y del colon en pacientes con síndrome carcinoide y diarrea. N Engl J Med. 1993;329:1073-1078.
7. Babovic-Vuksanovic D, Constantinou CL, Rubin J, et al. Familial occurrence of carcinoid tumors and association with other malignant neoplasms. Cancer Epidemiol Biomarkers Prev. 1999;8:715-719.
8. Gough DB, Thompson GB, Crotty TB, et al. Diversas características clínicas y patológicas del carcinoide gástrico y la relevancia de la hipergastrinemia. World J Surg. 1994;18:473-479.
9. Cross A, Leitzmann MF, Subar AF, et al. A prospective study of meat and fat intake in relation to small intestinal cancer. Cancer Res. 2008;68:9274-9279.
10. Red Nacional Integral del Cáncer. Guías de práctica clínica en oncología de la NCCN (NCCN guidelines®): tumores neuroendocrinos. Versión 3.2017. www.nccn.org/professionals/physician_gls/PDF/neuroendocrine.pdf. Consultado el 11 de octubre de 2017.
11. Maroun J, Kocha W, Kvols L, et al. Guías para el diagnóstico y manejo de los tumores carcinoides. Parte 1: el tracto gastrointestinal. Una declaración de un grupo nacional canadiense de expertos en carcinoides. Curr Oncol. 2006;13:67-76.
12. Eriksson B, Oberg K, Stridsberg M. Tumor markers in neuroendocrine tumors. Digestion. 2000;62(suppl 1):33-38.
13. van der Lely AJ, de Herder WW. Carcinoid syndrome: diagnosis and medical management. Arq Bras Endocrinol Metabol. 2005;49:850-860.
14. Cives M, Strosberg J. Treatment strategies for metastatic neuroendocrine tumors of the gastrointestinal tract. Curr Treat Options Oncol. 2017;18:14.
15. Enzler T, Fojo T. Análogos de la somatostatina de acción prolongada en el tratamiento de los tumores neuroendocrinos irresecables/metastásicos. Semin Oncol. 2017;44:141-156.
16. Octreotida. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Consultado el 11 de octubre de 2017.
17. Lanreotide. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Consultado el 11 de octubre de 2017.
18. Narayanan S, Kunz PL. Papel de los análogos de la somatostatina en el tratamiento de los tumores neuroendocrinos. Hematol Oncol Clin N Am. 2016;30:163-177.
19. Vinik AI, Wolin EM, Liyanage N, et al. Evaluación de la eficacia y seguridad de lanreotide depot/autogel como tratamiento del síndrome carcinoide (ELECT): un ensayo aleatorizado, doble ciego y controlado con placebo. Endocr Pract. 2016;22:1068-1080.
20. Kvols LK, Oberg KE, O’Dorisio TM, et al. Pasireotide (SOM230) muestra eficacia y tolerabilidad en el tratamiento de pacientes con tumores neuroendocrinos avanzados refractarios o resistentes a octreotide LAR: resultados de un estudio de fase II. Endocr Relat Cancer. 2012;19:657-666.
21. Wolin EM, Jarzab B, Eriksson B, et al. Estudio de fase III de pasireotida de liberación prolongada en pacientes con tumores neuroendocrinos metastásicos y síntomas carcinoides refractarios a los análogos de somatostatina disponibles. Drug Des Devel Ther. 2015;9:5075-5086.
22. Pasireotide. Micromedex Solutions. Greenwood Village, CO: Truven Health Analytics. www.micromedexsolutions.com. Consultado el 23 de octubre de 2017.
23. Markham A. Telotristat etílico: primera aprobación mundial. Fármacos. 2017;77:793-798.
24. Telotristat. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Consultado el 11 de octubre de 2017.
25. Kulke MH, Hörsch D, Caplin ME, et al. Telotristat etílico, un inhibidor de la triptófano hidroxilasa para el tratamiento del síndrome carcinoide. J Clin Oncol. 2017;35:14-23.