Resumen
Antecedentes
El diagnóstico del infarto agudo de miocardio (IAM) se confirma actualmente mediante la determinación de la Troponina I plasmática (pTi). Basándose en los informes anteriores, de que las plaquetas de los sujetos con IAM agregadas por diferentes agentes agregadores no podían ser inhibidas por el ácido acetil salicílico (aspirina), se estudió la viabilidad del diagnóstico de IAM.
Métodos
En el estudio participaron sujetos de entre 40-60 años con IAM (n=50, M=35, F=15) o SCA (n=30, M=20, F=10) y un número igual de voluntarios normales emparejados por edad y sexo. La inhibición de 80 µM de aspirina de la agregación plaquetaria inducida por 2,0 µM de ADP se estudió incubando el plasma rico en plaquetas (PRP) con el compuesto durante 30 minutos a 37°C y la agregación se realizó en un agregómetro óptico.
Resultados
Mientras que en el caso del PRP normal, la inhibición inducida por aspirina fue ≈100%. En el caso del SCA, el porcentaje de inhibición fue del 63,2% en comparación con los casos de IAM en los que no se encontró ninguna inhibición (es decir, 0% de inhibición, p<0,001) por parte de la aspirina en la agregación plaquetaria inducida por el ADP (sensibilidad= 92% y especificidad = 100%).
Conclusión
Fue factible diagnosticar la aparición de IAM por la ausencia del efecto inhibidor de la aspirina en la agregación plaquetaria.
Palabras clave
Agregación plaquetaria, diagnóstico de infarto de miocardio, troponina, aspirina.
Introducción
Se sabe que la agregación de las plaquetas por diferentes agentes agregadores de plaquetas, incluyendo el ADP, la l-epinefrina, el colágeno o la trombina, es esencial para el proceso de coagulación de la sangre que salva vidas. Por otra parte, la agregación excesiva de plaquetas en el lugar de la rotura de la placa aterosclerótica en la pared de la arteria coronaria da lugar al desarrollo de un trombo, un microagregado de plaquetas, que a veces puede provocar el bloqueo de la circulación sanguínea normal en la musculatura del corazón, y que en consecuencia puede dar lugar al síndrome coronario agudo (SCA) . Aunque la agregación de plaquetas en el lugar de la rotura de la placa arterial puede dar lugar a un SCA, la agregación de plaquetas también puede bloquear en ocasiones la arteria pericárdica, lo que puede provocar la muerte de las células cardíacas, que aparecen como zonas oscuras y parcheadas de infartos debido a la muerte de las células cardíacas que, en última instancia, pueden dar lugar a un infarto agudo de miocardio (IAM), que cuando es masivo, puede provocar la muerte de las víctimas. Los infartos transmurales dependen de la extensión del daño en el miocardio, que puede o no expresarse siempre como una onda Q anormal, pero que también puede estar implicada en la aparición de ondas ST y T anormales en el 50% de los casos en el ECG, lo que da lugar a un infarto de miocardio con elevación del segmento ST (IAMCEST) o sin él, por lo que el ECG puede no ser útil desde el punto de vista diagnóstico para determinar la aparición de un IAM. Aunque el dolor torácico suele ser intenso y durar más tiempo que en el caso del SCA, se sabe que el dolor en sí mismo es de naturaleza subjetiva y puede ser un evento simulado por el propio IAM. Y, como tal, el diagnóstico del IAM suele confirmarse mediante la determinación de la troponina I plasmática (pTi) por medio de un ensayo inmunoabsorbente ligado a enzimas (ELISA) utilizando un anticuerpo contra la troponina I.
Sin embargo, tanto la troponina I (Ti) como su anticuerpo son caros y, además, el propio ELISA puede no ser siempre lo suficientemente rápido como para confirmar la aparición de un IAM en una situación exigente que puede ser necesaria para la posible intervención terapéutica de la afección. Por estas razones, el diagnóstico de laboratorio del IAM no está disponible, no necesariamente por elección, en muchas partes del mundo.
Recientemente hemos informado de que el Plasma Rico en Plaquetas (PRP) de pacientes con IAM preincubado con 80 µM de ácido acetil salicílico (aspirina), durante 30 minutos a 37°C no pudo inhibir la agregación de las plaquetas iniciada por diferentes agentes agregadores de plaquetas, incluyendo el ADP, cuando se comparó con el PRP normal o el PRP del SCA. Basándonos en estos estudios preliminares, hemos estudiado la posibilidad de confirmar la aparición de IAM mediante agregometría óptica incluso en ausencia de la determinación del pTi.
Aquí informamos de la viabilidad de confirmar la aparición de IAM diferenciada de la aparición de SCA mediante la determinación de la inhibición inducida por aspirina de la agregación plaquetaria inducida por ADP utilizando un agregómetro. La ocurrencia de IAM se confirmó mediante la determinación paralela y simultánea de la pTi por ELISA.
Métodos y materiales
Autorización ética
El proyecto de investigación, »Diagnóstico de laboratorio del infarto agudo de miocardio mediante agregometría óptica de las plaquetas» requirió una cantidad nominal de sangre (2 mL) de los pacientes con IAM o SCA y de los voluntarios normales. La Junta de Revisión Institucional, el Comité de Ética de Investigación Animal del Instituto Sinha de Ciencia Médica y Tecnología, Calcuta, India, aprobó el estudio con la condición de que se siguiera el Protocolo de Ética Humana aprobado estrictamente de acuerdo con la declaración de Helsinki de 1964 y no se permitió ninguna desviación en el estudio sin el permiso previo por escrito de la junta. Todos los participantes tenían entre 40 y 60 años. No participaron en el estudio ni retrasados mentales, ni mujeres embarazadas, ni presos. Todos los voluntarios firmaron un formulario de consentimiento informado antes de su participación en el estudio. En los casos de sujetos con SCA o IAM, también se obtuvo el permiso para participar en el estudio de los familiares del paciente mediante la firma de una declaración jurada judicial. Los médicos de guardia decidieron si la muestra de sangre (2 ml) podía extraerse del paciente sin poner en peligro al sujeto. La sangre fue extraída por el médico de cabecera o por una enfermera autorizada. Se comprobó que los voluntarios no tenían ninguna otra infección que pusiera en peligro su vida. El comité inspeccionó el progreso y los problemas de la investigación actual de forma rutinaria.
Productos químicos
La inmunoglobulina G de cabra anti-conejo-fosfatasa alcalina y el ADP se obtuvieron de Sigma Aldrich. Las placas maxisorp de ensayo inmunoenzimático (ELISA) eran de Nunc, Rosaklide, Dinamarca. Los anticuerpos contra la troponina I, la CK-MB y la CK-MB se obtuvieron de Abcam. El ácido acetil salicílico (aspirina) se obtuvo de Medica Zydus Healthcare. Todos los demás productos químicos utilizados eran de grado analítico.
Selección de los pacientes con IAM
En el estudio participó un número total de 50 pacientes (n=50, M=35, F=15, de edades comprendidas entre los 40-60 años con dolor torácico que duró >120h. Estos sujetos fueron ingresados en la Unidad de Cuidados Intensivos del Colegio Médico y Hospital de Calcuta. No se incluyeron en el estudio los pacientes con diabetes mellitus o con infecciones potencialmente mortales. Como se sabe que la paricarditis, la embolia pulmonar y los trastornos aórticos e intestinales estimulan el dolor torácico debido al IAM o al SCA, los pacientes con estas afecciones se excluyeron cuidadosamente del estudio. Se excluyeron del estudio todos los participantes que habían sido hospitalizados por cualquier afección en los últimos seis meses o los pacientes que habían recibido aspirina en un plazo de dos semanas.
Selección de voluntarios normales
También se incluyó en el estudio un número igual de voluntarios normales emparejados por edad y sexo. Ninguno de los voluntarios normales tenía diabetes mellitus ni tenía antecedentes de hipertensión sistémica en el momento de la presentación. Ninguno de los voluntarios normales tenía una infección que pusiera en peligro su vida ni había sido hospitalizado por alguna afección en los últimos seis meses. Ninguna de las voluntarias había recibido alguna medicación anticonceptiva. Ninguna de las voluntarias había tomado aspirina o alguna medicación cardíaca en las últimas 4 semanas.
Diagnóstico de IAM
Todos los pacientes con IAM ingresaron en la unidad de cuidados cardíacos intensivos del hospital con el dolor torácico característico descrito anteriormente. Se incluyeron en el estudio pacientes con IAM con IAMCEST y sin IAMCEST. Todos los pacientes seleccionados tenían ondas Q en desarrollo en el ECG. Los casos en los que no se pudo demostrar claramente la aparición de ondas Q en el ECG fueron excluidos del estudio. La aparición de IAM se confirmó mediante los niveles de pTi por ELISA.
Diagnóstico de SCA
Como parte del estudio previsto, se incluyeron en el estudio 30 pacientes (n=30, M=20, F=20) con edades comprendidas entre los 40-60 años. Estos pacientes presentaban un dolor torácico característico. Se excluyeron del estudio aquellos pacientes que presentaban un bloqueo de rama y las regiones de isquemia cardíaca no podían determinarse mediante ECG.
La aparición de SCA se confirmó mediante la determinación de CK-MB en la muestra de sangre extrayendo la muestra en las 6h posteriores al ingreso en el hospital.
Las muestras de sangre, tanto en el caso del IAM como del SCA, se obtuvieron de los sujetos antes del inicio de cualquier terapia cardíaca para minimizar la ambigüedad.
Protocolo de estudio
Los pacientes seleccionados fueron aleatorizados y se asignó un número arbitrario a cada muestra de sangre del IAM, del SCA y de los voluntarios normales y se mantuvieron bajo la supervisión de un personal administrativo que no era investigador. El investigador no tenía conocimiento de si las muestras de sangre extraídas procedían de un IAM o un SCA o de un voluntario normal. Sólo después de la finalización del estudio, los investigadores disponían de la «clave» de la información relativa al estado del participante para los análisis estadísticos. Todas las muestras de sangre se estudiaron tan pronto como fue posible después de la retirada de la muestra.
Preparación del plasma rico en plaquetas (PRP)
El PRP de los sujetos se preparó mediante centrifugación como se ha descrito anteriormente.
El plasma libre de plaquetas (PFP) utilizado para la determinación de CK-MB o pTi se preparó centrifugando las muestras de sangre a 10.000 g a 0°C .
Inhibición de la agregación plaquetaria por la aspirina
Típicamente, el PRP de los sujetos con IAM, SCA o de los voluntarios normales se incubó con 80 µM de aspirina durante 30 min a 37°C. La agregación de las plaquetas se inició tratando el PRP con 2 µM de ADP preincubado con o sin aspirina. En los experimentos de control, el PRP se trató con un volumen igual de NaCl al 0,9% incubado a 37°C durante 30 min.
Preparación de la solución de aspirina
La solución de aspirina recién preparada se hizo disolviendo aspirina en agua desionizada y el pH se mantuvo en 7,0 añadiendo NaHCO3 0,1M. La solución de aspirina se desechó después de su uso.
Análisis de Troponina I y CK-MB en plasma
Los niveles de pTi y CK-MB se determinaron mediante ELISA utilizando el anticuerpo de Troponina I y el anticuerpo de CK-MB.
Análisis estadístico
Los resultados obtenidos se presentan como +/- desviación estándar, mientras que la significación de los resultados se determinó mediante la prueba t de Student. Se consideraron significativos los valores de p<0,05. En su caso, también se determinaron los coeficientes de correlación de Pearson ® de los resultados. La puntuación de Pearson «r», es tal que -1 ≤ r ≤ +1 es aceptable, donde los signos (+) y (-) se designan como correlaciones lineales positivas y negativas, respectivamente. Para los análisis estadísticos se utilizó el software Graph Pad Prism (Graph Pad Software, San Diego, y USA) y el software Micro Cal origin 6.0. La evaluación de la prueba diagnóstica y el análisis de la curva operativa del receptor (ROC) se realizaron con el software estadístico MedCalc, Bélgica. Según el análisis ROC, una prueba con discriminación perfecta (sin solapamiento en dos distribuciones) tiene una curva ROC que pasa por la esquina superior izquierda (100% de sensibilidad, 100% de especificidad). Por lo tanto, cuanto más cerca esté la curva ROC de la esquina superior izquierda, mayor será la precisión global de la prueba. Se cuantificó el área bajo la curva (AUC), que es una medida de lo bien que un parámetro puede distinguir entre dos grupos de diagnóstico (enfermo/normal).
Resultados
El efecto de la aspirina en la inhibición de la agregación plaquetaria inducida por el ADP en el PRP de los sujetos con SCA, IAM y de los voluntarios normales
Cuando el PRP de estos sujetos se incubó con 80 µM de aspirina durante 30 minutos a 37°C y se inició la agregación plaquetaria tratando el PRP con 2.0µM de ADP, se observó que sólo en el caso de la PRP de los sujetos con IAM, el compuesto no logró inhibir (0% de inhibición) la agregación plaquetaria. Por el contrario, en el caso del SCA (el porcentaje de inhibición oscilaba entre el 52% y el 68%) o en el caso del PRP normal, las plaquetas se inhibían en un 100% (Figura 1, panel A). El análisis de la curva del operador receptor (ROC) mostró una sensibilidad del 92% (intervalo de confianza [IC] del 95%: 91,0-100,0) y una especificidad del 100% (IC del 95%: 91,0-100,0, P<0,0001). El área bajo la curva (AUC) probada por el análisis ROC llegó a ser igual a 0,952 (Figura 1, Panel B).
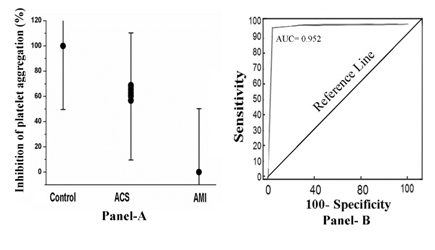
Figura 1. El porcentaje de inhibición de la agregación plaquetaria y el análisis de la curva del operador receptor en la PRP por aspirina en el caso de sujetos normales, con SCA y con IAM. Panel A: La PRP de sujetos normales, con SCA y con IAM se preparó como se describe en Materiales y Métodos y se incubó con 80 µM de aspirina durante 30 minutos a 37°C. Tras la incubación, se inició la agregación plaquetaria añadiendo 2 µM de ADP y se estudió en un agregómetro óptico. Panel B: Análisis de la curva ROC de la inhibición de la agregación plaquetaria en la que se traza la sensibilidad frente a la especificidad para diferentes puntos de corte. Cada punto de la curva ROC representa un par de sensibilidad/especificidad correspondiente a un umbral de decisión concreto, como se describe en Métodos y Materiales.
Relación entre el pTi y la inhibición de la agregación plaquetaria inducida por la aspirina mediante el ADP en el IAM, el SCA y en la PRP normal.
Como se muestra en la (Figura 2, Panel A), el aumento del pTi resultó estar inversamente relacionado con el grado de inhibición de la agregación plaquetaria inducido por la aspirina. En otras palabras, el aumento de la pTi, que fue máximo en el caso del IAM, también condujo al desarrollo de una resistencia máxima de las plaquetas al efecto inhibidor de la aspirina (coeficiente de correlación, r de Pearson= -0,967, con p<0.001), y la inhibición de la agregación plaquetaria inducida por la aspirina estaba relacionada al máximo con la ausencia total de pTi en el plasma normal y el nivel de pTi en el SCA era mayor que en el plasma normal, lo que demostraba que la troponina I también estaba presente en el plasma del SCA, aunque menos que en el IAM. El análisis de la curva del operador receptor (ROC) mostró una sensibilidad del 85% (intervalo de confianza [IC] del 95%: 81,0-92,0) y una especificidad del 78% (IC del 95%: 75,0-80,0, P<0,0001). El área bajo la curva (AUC) probada por el análisis ROC llegó a ser igual a 0,739 (Figura 2, Panel B).
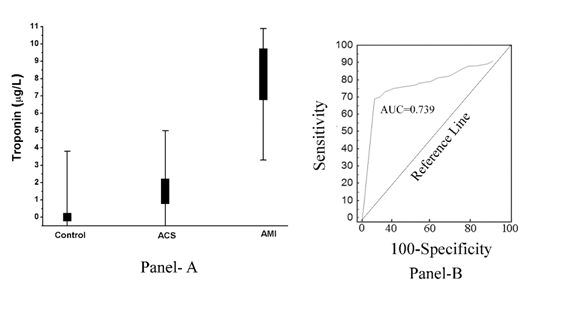
Figura 2. Nivel de troponina I en plasma en sujetos normales, con SCA e IAM y su análisis ROC. Panel A: El nivel de pTi se determinó mediante ELISA utilizando el anticuerpo de troponina I como se describe en Materiales y Métodos. Cada punto es en realidad una superposición de 50 pacientes normales, 30 con SCA y 50 con IAM. Panel B: El análisis de la curva ROC de los niveles de pTi en pacientes normales (no enfermos), IAM (enfermos) se construyó utilizando MedCalc como se describe en Métodos y Materiales.
Discusión
El infarto agudo de miocardio, del que se ha informado que está causado por una trombosis que provoca la muerte de las células cardíacas, podría ser el trastorno trombótico más peligroso que provoca un gran número de muertes entre las víctimas . A diferencia del SCA, cuya recurrencia se previene con la aspirina mediante la inhibición de la agregación excesiva de las plaquetas, las plaquetas del IAM son resistentes al efecto inhibidor del compuesto debido a la aparición de la isoforma 2 de la dermcidina (DCN-2) en la circulación. Lamentablemente, debido a la falta de inhibición de la agregación plaquetaria inducida por la aspirina, la mayoría de las víctimas de la primera vez tuvieron una recurrencia del IAM en el plazo de meses y sucumbieron a la enfermedad. Se ha informado de que el DCN-2 es un potente inhibidor de la síntesis de óxido nítrico (NO) inducida por la aspirina. Recientemente se ha informado de que eliminando la DCN-2 unida a la superficie de las plaquetas a través de un aumento de la síntesis de NO en las plaquetas, es posible resensibilizar las plaquetas del IAM al efecto de la aspirina .
No sólo el tratamiento y la prevención del IAM a través de una intervención terapéutica adecuada sigue siendo problemático, incluso el diagnóstico de laboratorio de la afección, diferenciado de la aparición de SCA, sigue siendo prohibitivamente caro para muchos laboratorios del mundo que suele ser necesario para la confirmación del IAM por el nivel de pTi. Esto se debe al hecho de que tanto la troponina I como su anticuerpo no sólo son caros, sino que el propio ensayo por ELISA necesita un equipo especial y los productos químicos y suministros necesarios, lo que podría suponer un procedimiento que requiere mucho tiempo y en una situación de necesidad en la que una aparición rápida y confirmatoria del IAM es esencial para la intervención terapéutica. Además, la interacción entre un antígeno y su anticuerpo no sigue la conocida estequiometría química, por lo que el propio ensayo puede presentar problemas en la validez de la interpretación de los datos. Además, el diagnóstico de SCA, diferenciado del de IAM, mediante la determinación de la CK-MB plasmática por sí misma es un procedimiento costoso.
Los resultados presentados anteriormente sugieren fuertemente la viabilidad del diagnóstico de IAM, diferenciado de la aparición de SCA, mediante una simple agregometría plaquetaria utilizando un agregómetro ordinario de laboratorio en el plazo de una hora (Sensibilidad= 92% y Especificidad= 100% según lo determinado por el análisis ROC). La curva de la prueba diagnóstica, tal como se describe en los materiales y métodos, pasa cerca de la esquina superior izquierda (figura 1, panel B), lo que implica una precisión cercana al 100% de la prueba diagnóstica en comparación con la pTi (figura 2, panel B).
Además, como la agregación de las plaquetas en la PRP no puede ser inhibida por la aspirina en el IAM, pero las plaquetas de la PRP de los sujetos con SCA sí podrían serlo, el diagnóstico del IAM mediante la agregometría plaquetaria podría ser un evento económico, así como un «todo o nada», es decir.Es decir, la agregación de las plaquetas del IAM podía o no podía conseguirse en absoluto con el tratamiento del PRP con aspirina, en cambio la agregación de las plaquetas de los pacientes con SCA podía inhibirse notablemente con el mismo compuesto (Figura 1). Sin embargo, se comprobó que incluso las plaquetas del SCA eran algo más resistentes al efecto inhibidor de la aspirina que en el caso de las plaquetas normales. Por otra parte, las plaquetas del IAM presentaban una resistencia máxima al efecto de la aspirina que estaba inversamente relacionada con los niveles de pTi (el coeficiente de correlación (r) entre el nivel de pTi y el % de inhibición por la aspirina fue de -0967, p<0,001).
Debe mencionarse en el contexto anterior que un diagnóstico rápido y confirmatorio del IAM es necesario para el uso de la terapia trombolítica que puede reducir la tasa de mortalidad en el IAM en un 30-50% . También hay que tener en cuenta que alrededor del 50% de los pacientes con aumento de pTi no tienen ni elevación del ST ni ondas Q en el ECG, por lo que el diagnóstico agregométrico plaquetario del IAM podría ser un método incluso más útil desde el punto de vista diagnóstico que el ECG, y al mismo tiempo es mucho menos costoso que el ELISA para la determinación de pTi.
La cuantificación de pTi en la circulación de los pacientes con IAM se suele realizar como proteína marcadora confirmatoria del IAM. Sin embargo, en un estudio preliminar se encontró que la pTi era también un inhibidor de la síntesis de NO y un potente inductor de la agregación plaquetaria en los rangos (nM) similares a los niveles de pTi en el plasma del IAM (sin publicar). Sin embargo, como el nivel plasmático de troponina I en el SCA era mayor que el del plasma normal, pero mucho menor que en el caso del IAM, estos resultados sugerían que el aumento de la pTi también se producía en el SCA, pero casi 6 veces menos que en el IAM. No obstante, estos resultados sugirieron que el aumento de pTi en comparación con el plasma normal por sí solo puede no confirmar necesariamente la ocurrencia de IAM diferenciado de la posible ocurrencia de SCA.
Recientemente hemos informado de que el dolor anginoso característico en el IAM estaba relacionado con la grave reducción del nivel de NO en el plasma que se debía a la inhibición de la síntesis de NO por DCN-2 u otros inhibidores sistémicos de la óxido nítrico sintasa . Como se ha descubierto que el pTi es un nuevo agente agregador de plaquetas (no publicado), a través de la inhibición de la NOS en las plaquetas, es posible que el propio pTi pueda estar implicado en el dolor anginoso, al menos en parte, en el IAM. El vertido de pTi en la circulación desde los músculos cardíacos podría ser trombogénico por sí mismo y podría contribuir al desarrollo de resistencia al efecto inhibidor de la aspirina en las plaquetas del IAM, de forma similar al efecto de la DCN- 2, lo que daría lugar al inicio o al agravamiento del cuadro. Y por lo tanto, la presencia de pTi podría tener por sí misma un papel ominoso en el desarrollo de la resistencia al efecto inhibidor de la aspirina en las plaquetas en el IAM que conduce a la recurrencia de la afección.
- Colman RW, Walsh PN (1987) Haemostasis andthrombosis. En: Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphia, PA (USA), J.B. Lippincott: 594-605.
- Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Plaque rupture, thrombosis, and therapeutic implications. Haemostasis 4: 269-284.
- Page DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) Myocardial changes associated with cardiogenic shock. N Engl J Med 285: 133-137.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inhibición de la agregación de las plaquetas de la sangre humana y la estimulación de la síntesis de óxido nítrico por la aspirina. Platelets 14: 421-427.
- Zweig MH1, Campbell G (1993) Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 39: 561-577.
- Bank S, Jana P, Maiti S, Guha S, Sinha AK (2014) Anulación inducida por la isoforma 2 de la dermcidina del efecto del ácido acetil salicílico en la agregación plaquetaria en el infarto agudo de miocardio. Sci Rep 4: 5804.
- Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) La aparición de la dermcidina isoforma 2, un nuevo agente de agregación plaquetaria en la circulación en el infarto agudo de miocardio que inhibe la síntesis de insulina y la restauración por el ácido acetil salicílico de sus efectos. J Thromb Thrombolysis 31: 13-21.
- Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Reducción de la dispersión del intervalo QT mediante una terapia trombolítica exitosa en el infarto agudo de miocardio. Investigadores del estudio TEAM-2. Circulation 90: 94-100.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Reducción de la tasa de mortalidad por infarto agudo de miocardio en sujetos con cáncer a través de la restauración sistémica del óxido nítrico deteriorado. PLoS One 9: e88639.