Hechos, resumen & Definición
- Las enzimas alostéricas son enzimas que tienen un sitio adicional para que se una un efector, además del sitio activo
- Los efectores regulan la actividad de la enzima – pueden activar o inhibir
- Las enzimas alostéricas son más grandes y complejas que las enzimas normales
- Se regulan a través de la regulación homotrópica o la regulación heterotrópica
¿Qué son las enzimas alostéricas?
Recordarás que las enzimas se clasifican como catalizadores biológicos. Es decir, ayudan a acelerar la velocidad de una reacción, pero permanecen inalteradas durante todo el proceso.
Las enzimas alostéricas son enzimas que tienen un sitio adicional, además del sitio activo -viene del griego ‘allo’, que significa ‘otro’-. Se denominan sitios alostéricos y las enzimas pueden tener más de uno. Son únicas porque tienen la capacidad de responder a múltiples condiciones diferentes en su entorno inmediato. Además, cuando las enzimas alostéricas se muestran en un gráfico como velocidad frente a la concentración de sustrato, muestran una curva sigmoidea en lugar de la curva hiperparabólica habitual.
La imagen siguiente muestra una enzima alostérica genérica.

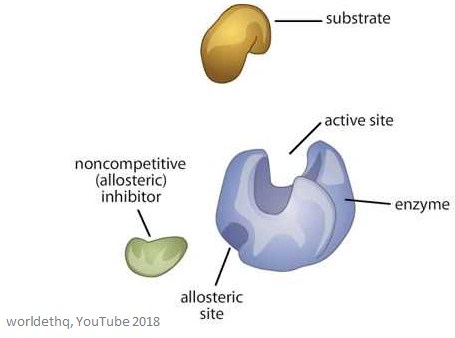
Propiedades de las enzimas alostéricas
Los sitios alostéricos son sitios de unión en la enzima – son diferentes del sitio activo y del sitio de unión del sustrato.
La molécula que se une al sitio alostérico se llama efector (también puede llamarse modulador), y regula la actividad de la enzima a la que se une.
La actividad de la enzima aumenta cuando un efector alostérico positivo se une al sitio alostérico. Esto significa que la actividad de la enzima disminuye cuando un efector alostérico negativo se une al sitio alostérico – inhiben la enzima.
Las enzimas alostéricas son más grandes y complejas que las enzimas no alostéricas y suelen tener muchas subunidades. Las enzimas con más de un efector tienen sitios de unión diferentes y específicos para cada uno. En la mayoría de las enzimas alostéricas, el sitio de unión del sustrato y el sitio de unión del efector se encuentran en subunidades diferentes.
El sitio de unión del sustrato se encuentra en la subunidad catalítica – a menudo denominada subunidad C. El sitio de unión del efector se encuentra en la subunidad reguladora, a menudo denominada subunidad R.
Cuando una molécula efector en un sitio de unión provoca un cambio conformacional en esa subunidad, se produce un cambio conformacional en las otras subunidades de la proteína, lo que significa que una gran parte de la energía de unión del efector se utiliza para cambiar la conformación de todo el complejo proteico.
Esta interacción entre todas las subunidades puede expresarse utilizando el coeficiente de Hill – también llamado coeficiente de cooperatividad. Cuando n=1, no habrá interacción entre las subunidades de la enzima. Cuanto mayor sea el coeficiente de Hill (coeficiente de cooperatividad), más fuertes serán las interacciones entre todas las subunidades de la enzima.
Las enzimas alostéricas también pueden «cambiar» entre su forma activa y su forma inactiva. Esto permite establecer sofisticados patrones de respuesta en la actividad, que pueden desempeñar un enorme papel en la función biológica. Una vez que el efector se disocia del sitio de unión, la enzima es capaz de volver a su forma inactiva (o menos activa). Pueden controlar las tasas de reacciones muy importantes, como la producción de ATP.
Cuando un efector se une a una enzima, se denomina unión cooperativa.
Regulación homotrópica
Un efector alostérico homotrópico es un sustrato para la enzima, así como una molécula reguladora – el prefijo «homo» se refiere a que son lo mismo. Suelen ser activadores de la enzima. La siguiente imagen muestra un efector alostérico homotrópico.

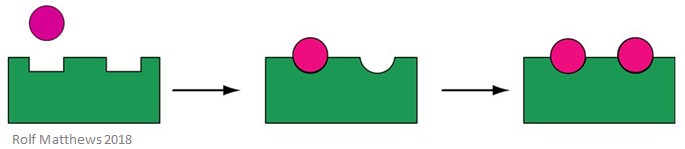
Un buen ejemplo de efector alostérico homotrópico es el oxígeno (O2) – actúa como efector de la hemoglobina en el cuerpo humano.
Regulación heterotrópica
Un efector alostérico heterotrópico es una molécula reguladora que no es también el sustrato de la enzima. Puede activar o inhibir la enzima a la que se une. La siguiente imagen muestra un efector alostérico heterotrópico.

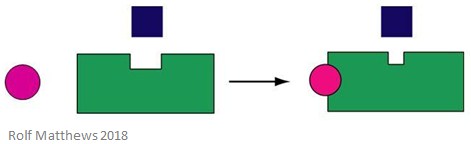
Un buen ejemplo de efector alostérico heterotrópico es el dióxido de carbono (CO2) – también actúa como efector de la hemoglobina pero no es el sustrato de la enzima.
Activadores esenciales
Los activadores esenciales son activadores alostéricos que, sin ellos, la actividad de la enzima sería tan baja que sería insignificante. Por ejemplo, el N-acetilglutamato es un activador esencial para la carbamoil fosfato sintetasa I. Son exactamente lo contrario de los inhibidores enzimáticos.