Apéndice 7: Pruebas de una nueva entidad: J.J. Thomson y el electrón
Al hablar de la existencia de los electrones, Ian Hacking escribió: «En lo que a mí respecta, si se pueden pulverizar, entonces son reales» (Hacking 1983, p. 23). A continuación, profundizó en este punto de vista. «Estamos completamente convencidos de la realidad de los electrones cuando nos proponemos construir -y a menudo lo conseguimos- nuevos tipos de dispositivos que utilizan diversas propiedades causales bien conocidas de los electrones para interferir en otras partes más hipotéticas de la naturaleza» (p. 265).
A Hacking le preocupaba que la simple manipulación de la primera cita, el cambio de la carga en una gota de aceite o en una esfera superconductora deniobio, que implica sólo la carga del electrón, fuera motivo suficiente para creer en los electrones. Su segunda ilustración, que creía más convincente porque implicaba varias propiedades del electrón, era la de Peggy II, una fuente de electrones polarizados construida en el Centro del Acelerador Lineal de Stanford a finales de la década de 1970. Peggy II proporcionó electrones polarizados para un experimento que dispersaba electrones del deuterio para investigar la corriente neutra débil. Aunque estoy de acuerdo con Hacking en que la manipulabilidad a menudo puede proporcionarnos motivos para creer en una entidad teórica, su ilustración llega muy lejos. Los físicos manipulaban el electrón en el sentido de Hacking a principios del siglo XX. Creían en la existencia de los electrones mucho antes de Peggy II, y voy a argumentar que tenían buenas razones para esa creencia.
La posición que adopto es una que podría llamarse razonablemente realismo «conjetural». Es conjetural porque, a pesar de tener buenas razones para creer en la existencia de una entidad o en la verdad de una ley científica, podríamos estar equivocados. En su día, los científicos tenían buenas razones para creer en el flogisto y el calórico, sustancias que ahora tenemos buenas razones para creer que no existen. Mi posición incluye tanto la opinión de Sellars de que «tener una buena razón para sostener una teoría es ipsofacto tener una buena razón para sostener que las entidades postuladas por la teoría existen» (Sellars 1962, p. 97), como el «realismo de entidad» propuesto por Cartwright (1983) y por Hacking (1983). Tanto Hacking, como se ha mencionado anteriormente, como Cartwright hacen hincapié en la manipulabilidad de una entidad como criterio para creer en su existencia. Cartwright también destaca el razonamiento causal como parte de su creencia en las entidades. En su discusión sobre el funcionamiento de una cámara de nubes afirma: «…si no hay electrones en la cámara de nubes, no sé por qué las huellas están ahí» (Cartwright, 1983, p.99). En otras palabras, si tales entidades no existen, entonces no tenemos ninguna historia causal plausible que contar. Tanto Hacking como Cartwright conceden existencia a entidades como los electrones, pero no otorgan un estatus «real» ni a las leyes ni a las teorías, que pueden postular o aplicar a dichas entidades.
En contraste con Cartwright y Hacking, sugiero que también tenemos buenas razones para creer en las leyes y teorías que rigen el comportamiento de las entidades, y que varias de sus ilustraciones implican implícitamente dichas leyes. En otro lugar he defendido la creencia en la realidad de las leyes científicas (Franklin 1996). En esta sección me concentraré en la realidad y la existencia de entidades, en particular, el electrón. Estoy de acuerdo con Hacking y Cartwright en que podemos ir más allá de Sellars y tener buenas razones para creer en entidades incluso sin leyes. Hacking y Cartwright hacen hincapié en la experimentación con entidades. Yo argumentaré que la experimentación con entidades y la medición de sus propiedades también pueden proporcionar motivos para creer en su existencia.
En esta sección discutiré los motivos para creer en la existencia del electrón examinando los experimentos de J.J. Thomson sobre los rayos catódicos. Su experimento de 1897 sobre los rayos catódicos se considera generalmente como el «descubrimiento» del electrón.
El propósito de los experimentos de J.J. Thomson fue claramente declarado en la introducción de su artículo de 1897.
Los experimentos que se discuten en este artículo se llevaron a cabo con la esperanza de obtener alguna información sobre la naturaleza de los rayos catódicos. Según la opinión casi unánime de los físicos alemanes, se deben a algún proceso en el éter al que -en la medida en que en un campo magnético uniforme su curso es circular y no rectilíneo- ningún fenómeno hasta ahora observado es análogo: otra opinión sobre estos rayos es que, lejos de ser totalmente etéreos, son de hecho totalmente materiales, y que marcan las trayectorias de las partículas de materia cargadas con electricidad negativa (Thomson 1897, p. 293).
La primera tarea de Thomson fue demostrar que los rayos catódicos llevaban carga negativa. Se supone que esto había sido demostrado previamente por Perrin. Perrin colocó dos cilindros metálicos coaxiales, aislados entre sí, frente a un cátodo plano. Cada uno de los cilindros tenía un pequeño orificio a través del cual los rayos catódicos podían pasar al cilindro interior, mientras que el cilindro exterior estaba conectado a tierra. Cuando los rayos catódicos pasaban al cilindro interior, un electroscopio conectado a él mostraba la presencia de una carga eléctrica negativa. Cuando los rayos catódicos se desviaban magnéticamente para que no pasaran por los agujeros, no se detectaba ninguna carga. «Ahora bien, los partidarios de la teoría etérea no niegan que se disparen partículas electrificadas desde el cátodo; sin embargo, niegan que estas partículas cargadas tengan más relación con los rayos catódicos que la que tiene una bala de rifle con el destello cuando se dispara un rifle» (Thomson 1897, p. 294).
Thomson repitió el experimento, pero de una forma que no se prestaba a esa objeción. El aparato se muestra en la figura 14. Se muestran los dos cilindros coaxiales con agujeros. El cilindro exterior estaba conectado a tierra y el interior a un electrómetro para detectar cualquier carga. Los rayos catódicos deA pasan a la bombilla, pero no entran en los agujeros de los cilindros a menos que sean desviados por un campo magnético.
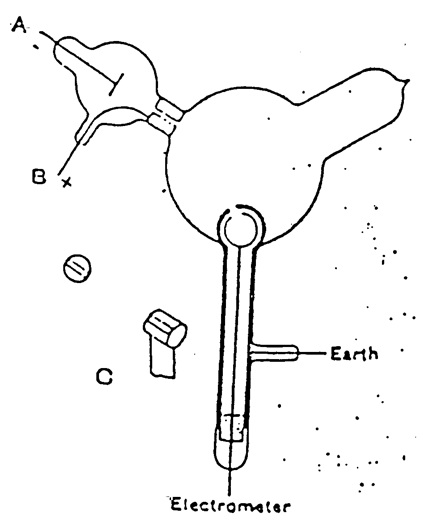
Figura 14.Aparato de Thomson para demostrar que los rayos catódicos tienen carga negativa. Se muestran las rendijas de los cilindros. Tomado de Thomson (1897).
Cuando los rayos catódicos (cuya trayectoria era trazada por la fosforescencia en el vidrio) no caían en la rendija, la carga eléctrica enviada al electrómetro cuando la bobina de inducción que producía los rayos se ponía en funcionamiento era pequeña e irregular; sin embargo, cuando los rayos eran doblados por un imán para que cayeran en la rendija había una gran carga de electricidad negativa enviada al electrómetro…. Si los rayos eran tan doblados por el imán que sobrepasaban las rendijas del cilindro, la carga que pasaba al cilindro volvía a caer a una fracción muy pequeña de su valor cuando la puntería era verdadera. Por lo tanto, este experimento demuestra que, independientemente de cómo se desvíen los rayos catódicos mediante fuerzas magnéticas, la electrificación negativa sigue el mismo camino que los rayos, y que esta electrificación negativa está indisolublemente conectada con los rayos catódicos (Thomson 1897, p. 294-295, énfasis añadido).
Este experimento también demostró que los rayos catódicos eran desviados por un campo magnético exactamente de la manera que uno esperaría si fueran partículas materiales con carga negativa.
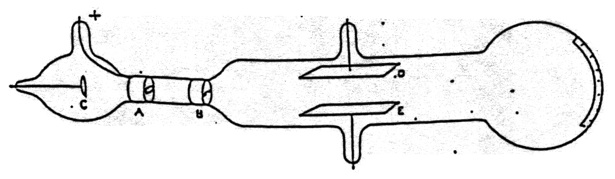
Figura 15.Aparato de Thomson para demostrar que los rayos catódicos son desviados por un campo eléctrico. También se utilizó para medir (\bfrac{m}{e}\). De Thomson (1897).
Sin embargo, la opinión de que los rayos catódicos eran partículas con carga negativa planteaba un problema. Varios experimentos, en particular los de Hertz, no habían observado la desviación de los rayos catódicos por un campo electrostático. Thomson procedió a responder a esta objeción. Su aparato se muestra en la figura 15. Los rayos catódicos de C pasan a través de una rendija en el ánodo A, y a través de otra rendija en B. Luego pasan entre las placas D y E y producen una mancha fosforescente estrecha y bien definida en el extremo del tubo, que también tenía una escala adjunta para medir cualquier desviación. Cuando Hertz realizó el experimento, no encontró ninguna desviación cuando se aplicó una diferencia de potencial entre D y E. Concluyó que las propiedades electrostáticas del rayo catódico son nulas o muy débiles. Thomson admitió que cuando realizó el experimento por primera vez tampoco vio ningún efecto. «Al repetir este experimento, obtuve al principio el mismo resultado, pero los experimentos posteriores mostraron que la ausencia de deflexión se debe a la conductividad conferida al gas enrarecido por los rayos catódicos». Al medir esta conductividad se descubrió que disminuía muy rápidamente a medida que aumentaba el agotamiento; parecía que al probar el experimento de Hertz a un agotamiento muy alto podría haber una posibilidad de detectar la deflexión de los rayos catódicos por una fuerza electrostática (Thomson 1897, p. 296).
Thomson concluyó:
Como los rayos catódicos llevan una carga de electricidad negativa, son desviados por una fuerza electrostática como si estuvieran electrificados negativamente, y son actuados por una fuerza magnética de la misma manera en que esta fuerza actuaría sobre un cuerpo electrificado negativamente que se moviera a lo largo de la trayectoria de estos rayos, no puedo ver ninguna escapatoria a la conclusión de que son cargas de electricidad negativa transportadas por partículas de materia. (Thomson 1897, p. 302)
Habiendo establecido que los rayos catódicos eran partículas materiales cargadas negativamente, Thomson pasó a discutir lo que eran las partículas: «¿Qué son estas partículas? son átomos, o moléculas, o materia en un estado aún más fino de subdivisión» (p. 302). Para investigar esta cuestión, Thomson realizó mediciones de la relación carga-masa de los rayos catódicos. El método de Thomson utilizaba tanto la deflexión electrostática como la magnética de los rayos catódicos. El aparato se muestra en la figura 15. También incluía un campo magnético que podía crearse perpendicularmente tanto al campo eléctrico como a la trayectoria de los rayos catódicos.
Consideremos un haz de partículas de masa \ (m\) carga\ (e\), y velocidad \ (v\). Supongamos que el haz atraviesa un campo eléctrico F en la región entre las placas D y E, que tiene una longitud \(L\). El tiempo que tarda una partícula en atravesar esta región\(t = \bfrac{L}{v}\). La fuerza eléctrica sobre la partícula es (Fe) y su aceleración es (a). La desviación d en el extremo de la región viene dada por
Consideremos ahora una situación en la que el haz de rayos catódicos atraviesa simultáneamente tanto \(F\) como un campo magnético\(B\) en la misma región. Thomson ajustó \ (B\) para que el rayo no se deflectara. así la fuerza magnética era igual a la fuerza electrostática.
Esto determinó la velocidad del rayo. Así,
Se midió cada una de las cantidades de la expresión anterior para poder determinar el valor de \(\bfrac{e}{m}\) o \(\bfrac{m}{e}\).
Usando este método, Thomson encontró un valor de \(\bfrac{m}{e}\) de \((1,29\pm 0,17)\Nmás de 10^{-7}\N). Este valor era independiente tanto del gas en el tubo como del metal utilizado en el cátodo, lo que sugiere que las partículas eran componentes de los átomos de todas las sustancias. También era mucho más pequeño, por un factor de 1000, que el valor más pequeño obtenido anteriormente, \(10^{-4}\), el del ion hidrógeno en la electrólisis.
Thomson comentó que esto podría deberse a la pequeñez de \(m\) o a la grandeza de \(e\). Argumentó que \(m\)era pequeño citando el trabajo de Lenard sobre el alcance de los rayos catódicos en el aire. El alcance, que está relacionado con el recorrido libre medio de las colisiones y que depende del tamaño del objeto, era de 0,5 cm. El camino libre medio de las moléculas en el aire era de aproximadamente \(10^{-5}\) cm. Si el rayo catódico viajaba mucho más lejos que una molécula antes de colisionar con una molécula de aire, Thomson argumentaba que debía ser mucho más pequeño que una molécula.
Thomson había demostrado que los rayos catódicos se comportaban como uno esperaría que se comportaran las partículas materiales con carga negativa. Depositaban carga negativa en un electrómetro, y eran desviados por los campos eléctricos y magnéticos en la dirección apropiada para una carga negativa.Además, el valor de la relación masa/carga era mucho menor que el valor más pequeño obtenido anteriormente, el del ion hidrógeno. Si la carga fuera la misma que la del ión hidrógeno, la masa sería mucho menor. Además, los rayos catódicos viajaban más lejos en el aire que las moléculas, lo que también implicaba que eran más pequeños que un átomo o una molécula. Thomson llegó a la conclusión de que estas partículas cargadas negativamente eran componentes de los átomos. En otras palabras, los experimentos de Thomson nos habían dado buenas razones para creer en la existencia de los electrones.
Volver a Experimento en Física