Objetivo de aprendizaje
1. Identificar los grupos funcionales aldehído, cetona, ácido y éter. Identificar los grupos funcionales aldehído, cetona, ácido, éster y éter.
2. Utilizar las convenciones de nomenclatura adecuadas para las moléculas que contienen aldehído, cetona, ácido carboxílico, éster y éter.

Si un enlace del grupo carbonilo se realiza a un átomo de hidrógeno, entonces la molécula se clasifica además como un aldehído. Al nombrar los aldehídos, la cadena principal de átomos de C debe incluir el carbono del grupo carbonilo, que se numera como posición 1 en la cadena de carbono. Se utiliza el nombre principal del hidrocarburo, pero se añade el sufijo -al. (No hay que confundir -al con -ol, que es el sufijo que se utiliza para los alcoholes.) Así que tenemos

El metanal tiene un nombre común con el que puede estar familiarizado: formaldehído. Lo principal a tener en cuenta sobre los aldehídos es que el grupo carbonilo está al final de una cadena de carbono.
Un grupo carbonilo en medio de una cadena de carbono implica que los dos enlaces restantes del grupo carbonilo se hacen a átomos de C. Este tipo de molécula se denomina cetona. A pesar de que los aldehídos y las cetonas tienen el mismo grupo carbonilo, tienen propiedades químicas y físicas diferentes y se agrupan adecuadamente como dos tipos de compuestos distintos. La cetona más pequeña tiene tres átomos de C. Al nombrar una cetona, tomamos el nombre del hidrocarburo padre y cambiamos el sufijo por -uno:

El nombre común de la propanona es acetona. En el caso de las cetonas más grandes, debemos utilizar un número de locante para indicar la posición del grupo carbonilo justo antes del sufijo, como hacíamos con los alquenos y alquinos:

Hay una forma no IUPAC de nombrar las cetonas que también se utiliza habitualmente: nombrar los grupos alquilo que están unidos al grupo carbonilo y añadir la palabra cetona al nombre. Así, la propanona también puede llamarse dimetil cetona, mientras que la butan-2-ona se llama metil etil cetona.
Ejemplo 9
Dibuja la estructura del pentan-2-ona.
Solución
Esta molécula tiene cinco átomos de C en cadena, con el grupo carbonilo en el segundo átomo de C. Su estructura es:

Ponte a prueba
Dibuja la estructura de la metilbutilcetona.
Responde

La combinación de un grupo funcional carbonilo y un grupo hidroxilo forma el grupo carboxilo.

Las moléculas con un grupo carboxilo se llaman ácidos carboxílicos. Al igual que los aldehídos, el grupo funcional de los ácidos carboxílicos se encuentra al final de una cadena de carbono. También como en el caso de los aldehídos, el átomo de C del grupo funcional se cuenta como uno de los átomos de C que definen el nombre del hidrocarburo padre. Para nombrar los ácidos carboxílicos, se utiliza el nombre padre del hidrocarburo, pero se añade el sufijo -oico:

El ácido metanoico y el ácido etanoico también se llaman ácido fórmico y ácido acético, respectivamente. El ácido fórmico es el compuesto que hace que ciertas picaduras de hormigas piquen, mientras que el ácido acético es la sustancia activa del vinagre.
¿Cómo de ácidos son los ácidos carboxílicos? Resulta que no son muy ácidos. Ningún ácido carboxílico está en la lista de ácidos fuertes (Tabla 12.2 «Ácidos y bases fuertes»). (Para más información sobre los ácidos fuertes, véase el apartado 12.4 «Ácidos y bases fuertes y débiles y sus sales»). Esto significa que todos los ácidos carboxílicos son ácidos débiles. Una solución 1 M de ácido fórmico sólo se disocia en aproximadamente 1.3% en iones H+ e iones formiato, mientras que una solución similar de ácido acético se ioniza en aproximadamente sólo 0.4%. Algunos ácidos carboxílicos son más fuertes; por ejemplo, el ácido tricloroacético está disociado en un 45% en solución acuosa. Pero ningún ácido carboxílico se acerca a la cantidad de disociación del 100% requerida por la definición de un ácido fuerte.
Sin embargo, como su nombre sugiere, los ácidos carboxílicos actúan como ácidos en presencia de bases. El átomo de H del grupo carboxilo se desprende como el ion H+, dejando un ion carboxilato:

Los iones carboxilato se nombran a partir del nombre del ácido: el ácido -oico se sustituye por -oato para nombrar el ion.
Ejemplo 10
Completa la reacción química. Puedes nombrar el ion carboxilato formado?

Solución
El ion OH- elimina el átomo de H que forma parte del grupo carboxilo:

El ion carboxilato, que tiene la fórmula estructural condensada CH3CO2-, es el ion etanoato, pero comúnmente se le llama ion acetato.
Ponte a prueba
Completa la reacción química. Puedes nombrar el ion carboxilato formado?

Respuesta

El ion es el ion metanoato, que comúnmente se llama ion formiato.
Una reacción a considerar es la de un ácido carboxílico y un alcohol. Cuando se combinan en las condiciones adecuadas, se eliminará una molécula de agua y los trozos restantes se combinarán para formar un nuevo grupo funcional: el grupo éster:

Nota cómo la molécula de ácido contribuye con un lado alquilo (representado por R), mientras que el alcohol contribuye con el otro lado (representado por R′). Los ésteres se nombran utilizando el nombre del grupo alquilo del alcohol más el nombre del carboxilato del ácido-por ejemplo, esta molécula se llama propanoato de metilo.

La química está en todas partes: Ésteres, fragancias y aromas
| Ester | Sabe/Huele | Ester | Sabe/Huele | |||||
|---|---|---|---|---|---|---|---|---|
| alil hexanoate | pineapple | isobutyl formate | raspberry | benzyl acetato | pera | acetato de isobutilo | pera | |
| piña | metil fenilacetato | miel | ||||||
| plátano | caprilato de nonilo | naranja | ||||||
| piña | acetato de pentilo | manzana | ||||||
| Heptanoato de etilo heptanoato | albaricoque | etanoato de propilo | pera | |||||
| pentanoato de etilo | manzana | isobutirato de propilo | rum |
Finalmente, el grupo funcional éter es un átomo de O que está unido a dos grupos orgánicos:
R-O-R′
Los dos grupos R pueden ser iguales o diferentes. La denominación de los éteres es como la forma alternativa de nombrar a las cetonas. En este caso, los grupos R se nombran secuencialmente y se añade la palabra éter. La molécula CH3OCH3 es éter dimetílico, mientras que CH3OCH2CH3 es éter metílico. El éter dietílico, otro éter, se utilizaba antiguamente como anestésico, pero su inflamabilidad y toxicidad hicieron que cayera en desgracia. Las moléculas de éter más pequeñas que son líquidas a temperatura ambiente son disolventes comunes para las reacciones químicas orgánicas.
Los puntos clave
- Los aldehídos, cetonas, ácidos carboxílicos, ésteres y éteres tienen grupos funcionales que contienen oxígeno.
- Se puede utilizar la denominación IUPAC para las moléculas que contienen aldehídos, cetonas, ácidos carboxílicos y ésteres y éteres.
Ejercicios
-
Nombra una similitud entre los grupos funcionales que se encuentran en los aldehídos y las cetonas. ¿Puedes nombrar una diferencia entre ellos?
-
Explica cómo se utiliza un ácido carboxílico para hacer un éster.
-
Nombra cada molécula.
a)
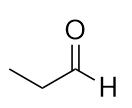
b)
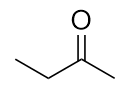
-
Nombra cada molécula.
a)
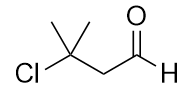
b)
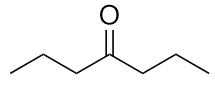 Nombra cada molécula.
Nombra cada molécula.a)
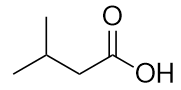
b)
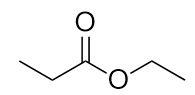 Nombre cada molécula.
Nombre cada molécula.a)
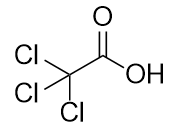
b)
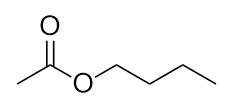 Nombra esta molécula.
Nombra esta molécula.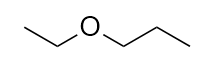 Nombre esta molécula.
Nombre esta molécula.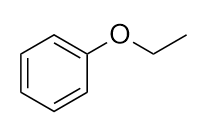
Da un nombre alternativo pero aceptable a la molécula del Ejercicio 3.2.
Da un nombre alternativo pero aceptable a la molécula del Ejercicio 4.2.
Completa esta reacción química.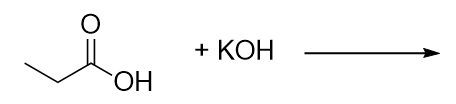 Completa esta reacción química.
Completa esta reacción química.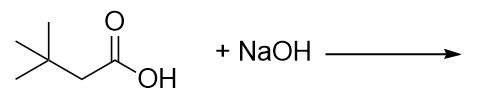
El fármaco conocido como aspirina tiene esta estructura molecular:
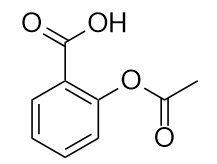
Identifica el/los grupo/s funcional/es de esta molécula.
- El fármaco conocido como naproxeno sódico es la sal sódica de esta molécula:
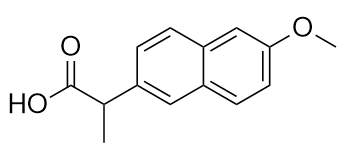
Identifique el grupo o grupos funcionales de esta molécula.
Identifica el éster que se forma al reaccionar estas moléculas.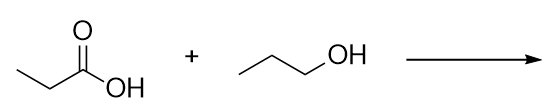 Identifica el éster formado al reaccionar estas moléculas.
Identifica el éster formado al reaccionar estas moléculas.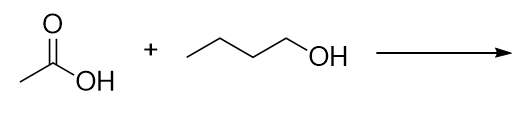
Respuestas
1. Ambos tienen un grupo carbonilo, pero un aldehído tiene el grupo carbonilo al final de una cadena de carbono, y el carbono carbonilo de una cetona está rodeado por otros dos carbonos.
a) propanal
b) butan-2-uno
a) ácido 3-metilbutanoico
b) propionato de etilo
7. éter de etilo propil
9. etil metil cetona
11. H2O + KCH3CH2CO213. ácido, éster y aromático (anillo de benceno)
15. propionato de propilo