Daño en el ADNEditar

El daño en el ADN se considera la principal causa subyacente de las neoplasias malignas conocidas como cánceres. Su papel central en la progresión al cáncer se ilustra en la figura de esta sección, en el recuadro cercano a la parte superior. (Las características centrales del daño en el ADN, las alteraciones epigenéticas y la reparación deficiente del ADN en la progresión al cáncer se muestran en rojo). Los daños en el ADN son muy comunes. Los daños en el ADN que se producen de forma natural (sobre todo debido al metabolismo celular y a las propiedades del ADN en el agua a la temperatura corporal) se producen a un ritmo de más de 60.000 nuevos daños, de media, por célula humana, al día . Pueden producirse daños adicionales en el ADN por la exposición a agentes exógenos. El humo del tabaco provoca un mayor daño exógeno en el ADN, y estos daños en el ADN son la causa probable del cáncer de pulmón debido al tabaquismo. La luz ultravioleta de la radiación solar provoca daños en el ADN que son importantes en el melanoma. La infección por Helicobacter pylori produce altos niveles de especies reactivas de oxígeno que dañan el ADN y contribuyen al cáncer gástrico. Los ácidos biliares, en niveles elevados en el colon de los seres humanos que siguen una dieta rica en grasas, también causan daños en el ADN y contribuyen al cáncer de colon. Katsurano et al. indicaron que los macrófagos y los neutrófilos en un epitelio colónico inflamado son la fuente de especies reactivas de oxígeno que causan los daños en el ADN que inician la tumorigénesis colónica. Algunas fuentes de daños en el ADN se indican en los recuadros de la parte superior de la figura de esta sección.
Los individuos con una mutación en la línea germinal que causa una deficiencia en cualquiera de los 34 genes de reparación del ADN (véase el artículo Trastorno por deficiencia de reparación del ADN) tienen un mayor riesgo de padecer cáncer. Algunas mutaciones de la línea germinal en los genes de reparación del ADN causan hasta un 100% de probabilidades de padecer cáncer a lo largo de la vida (por ejemplo, las mutaciones en el gen p53). Estas mutaciones de la línea germinal se indican en un recuadro a la izquierda de la figura con una flecha que indica su contribución a la deficiencia en la reparación del ADN.
Alrededor del 70% de las neoplasias malignas no tienen ningún componente hereditario y se denominan «cánceres esporádicos». Sólo una minoría de los cánceres esporádicos tienen una deficiencia en la reparación del ADN debido a la mutación de un gen de reparación del ADN. Sin embargo, la mayoría de los cánceres esporádicos presentan una deficiencia en la reparación del ADN debido a alteraciones epigenéticas que reducen o silencian la expresión del gen de reparación del ADN. Por ejemplo, de 113 cánceres colorrectales secuenciales, sólo cuatro tenían una mutación sin sentido en el gen de reparación del ADN MGMT, mientras que la mayoría tenía una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética). Cinco informes presentan pruebas de que entre el 40% y el 90% de los cánceres colorrectales tienen una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT.
De forma similar, de los 119 casos de cánceres colorrectales deficientes en reparación de emparejamientos erróneos que carecían de expresión del gen de reparación del ADN PMS2, en 6 de ellos la expresión de PMS2 era deficiente debido a mutaciones en el gen PMS2, mientras que en 103 casos la expresión de PMS2 era deficiente porque su pareja MLH1 estaba reprimida debido a la metilación del promotor (la proteína PMS2 es inestable en ausencia de MLH1). En los otros 10 casos, la pérdida de expresión de PMS2 se debió probablemente a la sobreexpresión epigenética del microARN, miR-155, que regula a la baja MLH1.
En otros ejemplos, se encontraron defectos epigenéticos en frecuencias de entre el 13% y el 100% para los genes de reparación del ADN BRCA1, WRN, FANCB, FANCF, MGMT, MLH1, MSH2, MSH4, ERCC1, XPF, NEIL1 y ATM. Estos defectos epigenéticos se produjeron en varios tipos de cáncer (por ejemplo, de mama, ovario, colorrectal y de cabeza y cuello). Dos o tres deficiencias en la expresión de ERCC1, XPF o PMS2 ocurren simultáneamente en la mayoría de los 49 cánceres de colon evaluados por Facista et al. Las alteraciones epigenéticas que causan una expresión reducida de los genes de reparación del ADN se muestran en un recuadro central en el tercer nivel desde la parte superior de la figura en esta sección, y la consiguiente deficiencia de reparación del ADN se muestra en el cuarto nivel.
Cuando se reduce la expresión de los genes de reparación del ADN, los daños en el ADN se acumulan en las células a un nivel superior al normal, y estos daños en exceso causan un aumento de las frecuencias de mutación o epimutación. Las tasas de mutación aumentan fuertemente en las células defectuosas en la reparación de los desajustes del ADN o en la reparación recombinacional homóloga (HRR).
Durante la reparación de las roturas de la doble cadena del ADN, o la reparación de otros daños en el ADN, los sitios de reparación incompletamente despejados pueden causar el silenciamiento epigenético de los genes. Las deficiencias en la reparación del ADN (nivel 4 de la figura) provocan un aumento de los daños en el ADN (nivel 5 de la figura) que dan lugar a un aumento de las mutaciones somáticas y de las alteraciones epigenéticas (nivel 6 de la figura).
Los defectos de campo, tejidos de apariencia normal con múltiples alteraciones (y que se comentan en la sección siguiente), son precursores comunes del desarrollo del clon de tejido desordenado y con proliferación inadecuada en una neoplasia maligna. Tales defectos de campo (segundo nivel desde la parte inferior de la figura) pueden tener múltiples mutaciones y alteraciones epigenéticas.
Una vez que se forma un cáncer, suele tener inestabilidad del genoma. Esta inestabilidad se debe probablemente a una reducción de la reparación del ADN o a un daño excesivo del mismo. Debido a dicha inestabilidad, el cáncer sigue evolucionando y produciendo subclones. Por ejemplo, un cáncer renal, muestreado en 9 áreas, tenía 40 mutaciones ubicuas, lo que demuestra la heterogeneidad del tumor (es decir, presente en todas las áreas del cáncer), 59 mutaciones compartidas por algunas (pero no todas las áreas) y 29 mutaciones «privadas» sólo presentes en una de las áreas del cáncer.
Defectos de campoEditar
Se han utilizado otros términos para describir este fenómeno, como «efecto de campo», «cancerización de campo» y «carcinogénesis de campo». El término «cancerización de campo» se utilizó por primera vez en 1953 para describir un área o «campo» de epitelio que ha sido precondicionado por procesos (en ese momento) en gran medida desconocidos para predisponerlo al desarrollo del cáncer. Desde entonces, los términos «cancerización de campo» y «defecto de campo» se han utilizado para describir el tejido premaligno en el que es probable que surjan nuevos cánceres.
Los defectos de campo son importantes en la progresión hacia el cáncer. Sin embargo, en la mayoría de las investigaciones sobre el cáncer, como señala Rubin «La gran mayoría de los estudios en la investigación del cáncer se ha realizado en tumores bien definidos in vivo, o en focos neoplásicos discretos in vitro. Sin embargo, hay pruebas de que más del 80% de las mutaciones somáticas encontradas en los tumores colorrectales humanos de fenotipo mutante se producen antes del inicio de la expansión clonal terminal. Del mismo modo, Vogelstein et al. señalan que más de la mitad de las mutaciones somáticas identificadas en los tumores se producen en una fase preneoplásica (en un defecto de campo), durante el crecimiento de células aparentemente normales. Asimismo, las alteraciones epigenéticas presentes en los tumores pueden haberse producido en defectos de campo preneoplásicos.
Una visión ampliada del efecto de campo se ha denominado «efecto de campo etiológico», que abarca no sólo los cambios moleculares y patológicos en las células preneoplásicas, sino también las influencias de los factores ambientales exógenos y los cambios moleculares en el microambiente local en la evolución neoplásica desde el inicio del tumor hasta la muerte del paciente.
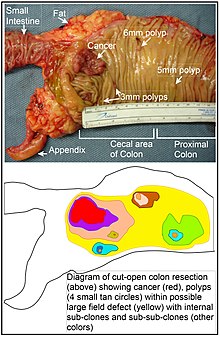
En el colon, un defecto de campo surge probablemente por selección natural de una célula mutante o epigenéticamente alterada entre las células madre de la base de una de las criptas intestinales en la superficie interior del colon. Una célula madre mutante o epigenéticamente alterada puede sustituir a las demás células madre cercanas por selección natural. Así, puede surgir un parche de tejido anormal. La figura de esta sección incluye una foto de un segmento del colon recién resecado y abierto longitudinalmente que muestra un cáncer de colon y cuatro pólipos. Debajo de la foto, hay un diagrama esquemático de cómo puede haberse formado un gran parche de células mutantes o epigenéticamente alteradas, mostrado por la gran área en amarillo en el diagrama. Dentro de este primer gran parche en el diagrama (un gran clon de células), puede producirse una segunda mutación o alteración epigenética de este tipo, de modo que una determinada célula madre adquiere una ventaja en comparación con otras células madre dentro del parche, y esta célula madre alterada puede expandirse clonalmente formando un parche secundario, o subclon, dentro del parche original. Esto se indica en el diagrama con cuatro parches más pequeños de diferentes colores dentro de la gran área amarilla original. Dentro de estos nuevos parches (subclones), el proceso puede repetirse múltiples veces, indicado por los parches aún más pequeños dentro de los cuatro parches secundarios (con colores aún diferentes en el diagrama) que se expanden clonalmente, hasta que surgen células madre que generan pequeños pólipos o bien una neoplasia maligna (cáncer).
En la foto, un aparente defecto de campo en este segmento de un colon ha generado cuatro pólipos (etiquetados con el tamaño de los pólipos, 6mm, 5mm, y dos de 3mm, y un cáncer de unos 3 cm de diámetro en su dimensión más larga). Estas neoplasias también se indican, en el diagrama que aparece debajo de la foto, con 4 pequeños círculos de color canela (pólipos) y una zona roja más grande (cáncer). El cáncer de la foto se produjo en la zona cecal del colon, donde el colon se une al intestino delgado (etiquetado) y donde se encuentra el apéndice (etiquetado). La grasa de la foto es externa a la pared exterior del colon. En el segmento de colon que se muestra aquí, el colon se abrió longitudinalmente para exponer la superficie interna del colon y mostrar el cáncer y los pólipos que se producen dentro del revestimiento epitelial interno del colon.
Si el proceso general por el que surgen los cánceres de colon esporádicos es la formación de un clon preneoplásico que se extiende por selección natural, seguido de la formación de subclones internos dentro del clon inicial, y de sub-subclones dentro de ellos, entonces los cánceres de colon generalmente deberían estar asociados con, y ser precedidos por, campos de anormalidad creciente que reflejan la sucesión de eventos premalignos. La región más extensa de anormalidad (el área irregular amarilla más externa en el diagrama) reflejaría el evento más temprano en la formación de una neoplasia maligna.
En la evaluación experimental de las deficiencias específicas de reparación del ADN en los cánceres, se demostró que muchas deficiencias específicas de reparación del ADN también ocurren en los defectos de campo que rodean esos cánceres. La Tabla, a continuación, da ejemplos para los que se demostró que la deficiencia de reparación del ADN en un cáncer estaba causada por una alteración epigenética, y las frecuencias algo menores con las que se encontró la misma deficiencia de reparación del ADN causada epigenéticamente en el defecto de campo circundante.
| Cáncer | Gen | Frecuencia en cáncer | Frecuencia en defecto de campo | Ref. |
|---|---|---|---|---|
| Colorrectal | MGMT | 46% | 34% | |
| Colorrectal | MGMT | 47% | 11% | |
| Colorrectal | MGMT | 70% | 60% | |
| Colorectal | MSH2 | 13% | 5% | |
| Colorectal | ERCC1 | 100% | 40% | |
| Colorrectal | PMS2 | 88% | 50% | |
| Colorrectal | XPF | 55% | 40% | |
| Cabeza y cuello | MGMT | 54% | 38% | |
| Cabeza y Cuello | MLH1 | 33% | 25% | |
| Cabeza y Cuello | MLH1 | 31% | 20% | |
| Estómago | MGMT | 88% | 78% | |
| MLH1 | 73% | 20% | ||
| Esófago | MLH1 | 77%-100% | 23%-79% |
Algunos de los pequeños pólipos en el defecto de campo que se muestra en la foto del segmento de colon abierto pueden ser neoplasias relativamente benignas. De los pólipos de menos de 10 mm de tamaño, encontrados durante la colonoscopia y seguidos con colonoscopias repetidas durante 3 años, el 25% no cambiaron de tamaño, el 35% retrocedieron o redujeron su tamaño, mientras que el 40% aumentaron de tamaño.
Inestabilidad del genomaEditar
Se sabe que los cánceres presentan inestabilidad del genoma o un fenotipo mutante. El ADN codificador de proteínas dentro del núcleo es aproximadamente el 1,5% del ADN genómico total. Dentro de este ADN codificador de proteínas (llamado exoma), un cáncer medio de mama o de colon puede tener entre 60 y 70 mutaciones que alteran las proteínas, de las cuales unas 3 o 4 pueden ser mutaciones «conductoras», y las restantes pueden ser mutaciones «pasajeras». Sin embargo, el número medio de mutaciones de la secuencia de ADN en todo el genoma (incluidas las regiones no codificadoras de proteínas) dentro de una muestra de tejido de cáncer de mama es de unas 20.000. En una muestra media de tejido de melanoma (donde los melanomas tienen una mayor frecuencia de mutaciones en el exoma) el número total de mutaciones en la secuencia de ADN es de unas 80.000. Esto se compara con la bajísima frecuencia de mutación de unas 70 mutaciones nuevas en todo el genoma entre generaciones (de padres a hijos) en los seres humanos.
Las altas frecuencias de mutaciones en el total de las secuencias de nucleótidos dentro de los cánceres sugieren que a menudo una alteración temprana en los defectos de campo que dan lugar a un cáncer (por ejemplo, el área amarilla en el diagrama de esta sección) es una deficiencia en la reparación del ADN. Facista et al. demostraron que los grandes defectos de campo que rodean a los cánceres de colon (que se extienden hasta unos 10 cm a cada lado de un cáncer) suelen tener defectos epigenéticos en 2 o 3 proteínas de reparación del ADN (ERCC1, XPF o PMS2) en toda la zona del defecto de campo. Las deficiencias en la reparación del ADN provocan un aumento de las tasas de mutación. Una deficiencia en la reparación del ADN, en sí misma, puede permitir que se acumulen daños en el ADN, y la síntesis de translesiones propensas a errores más allá de algunos de esos daños puede dar lugar a mutaciones. Además, la reparación defectuosa de estos daños acumulados en el ADN puede dar lugar a epimutaciones. Estas nuevas mutaciones o epimutaciones pueden proporcionar una ventaja proliferativa, generando un defecto de campo. Aunque las mutaciones/epimutaciones en los genes de reparación del ADN no confieren, por sí mismas, una ventaja selectiva, pueden ser transportadas como pasajeros en las células cuando éstas adquieren mutaciones/epimutaciones adicionales que sí proporcionan una ventaja proliferativa.