Propiedades de los compuestos iónicos
Debido a que todos los compuestos iónicos se forman cuando los aniones y los cationes se atraen entre sí, los compuestos iónicos suelen tener características similares.
Los compuestos iónicos forman cristales
Los compuestos iónicos están formados por cationes y aniones que se pegan entre sí debido a sus cargas opuestas. Imagina un solo catión de litio pegado junto a un solo anión de cloro para formar cloruro de litio. Ahora bien, es poco probable que sólo haya un ión de litio y un ión de cloro en este lugar… generalmente, cuando hablamos de reacciones químicas, estamos hablando de un enorme número de átomos que sufren una reacción en un lugar muy pequeño (una cucharadita de sal contiene aproximadamente 1022 átomos). Como resultado, si nuestro único par de LiCl se acercara a otro par de LiCl, tendría lugar lo siguiente:
Debido a que los iones con carga opuesta se atraen entre sí, los pares de LiCl tenderán a formar grupos más grandes. Estos grupos más grandes, a su vez, formarán grupos de iones aún más grandes, como se muestra en la siguiente figura:
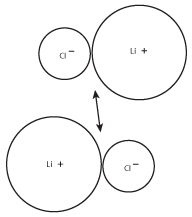
Figura 8.3La carga positiva del catión litio de un par será atraída por la carga negativa del ion cloruro del otro par.

Figura 8.4Este proceso, en el que las pilas de iones LiCl se combinan entre sí, continuará hasta que no haya más iones de litio o cloruro.
Los cristales son grandes disposiciones de iones o átomos que se apilan en patrones regulares. Muchos compuestos iónicos forman cristales muy grandes.
Estas grandes disposiciones de iones se denominan cristales. Aunque los cristales se forman frecuentemente a partir de compuestos iónicos, también existen en algunos otros compuestos químicos, como los diamantes. Hablaremos de esto con mucho más detalle en Sólidos.
Los hidratos se forman cuando una o más moléculas de agua se unen a compuestos iónicos. Estos compuestos son interesantes porque parecen secos pero desprenden agua cuando se calientan. Especialmente interesante es la sal de Epsom, o sulfato de magnesio heptahidratado (MgSO47H2O). Cuando se calienta, desprende suficiente agua como para disolver el sulfato de magnesio
Los compuestos iónicos suelen tener puntos de fusión y ebullición elevados
¿Qué ocurre cuando calientas algo en tu cocina? Es posible que hayas descubierto mientras cocinas (o mientras calientas en el microondas cosas al azar mientras estás aburrido) que la mayoría de los alimentos que comemos se derriten o se queman cuando se calientan. Algunos alimentos incluso hacen ambas cosas. Como probablemente adivine, soy un experto en apagar incendios domésticos.
Los compuestos iónicos, por otro lado, suelen fundirse y hervir a temperaturas mucho más altas que otros materiales. Para que los compuestos iónicos se fundan, hay que añadir suficiente energía para que los cationes y los aniones se alejen unos de otros. Como estas atracciones son tan fuertes, se necesita mucha energía para separar estos iones. Para añadir esta energía a los compuestos iónicos se necesita una gran cantidad de calor, razón por la cual los compuestos iónicos tienen puntos de fusión y ebullición muy altos.
Los compuestos iónicos son duros y quebradizos
Imagínate golpeando un gran trozo de cloruro de litio contra tu cabeza. ¿Qué crees que se puede sentir? Si has adivinado que te dolería muchísimo, estabas en lo cierto. Al igual que muchos compuestos iónicos, el cloruro de litio es tan duro como una roca.
Los compuestos iónicos son extremadamente duros porque es difícil hacer que los iones se separen unos de otros en un cristal. Incluso si aplicas una gran fuerza sobre el cristal (imagina que corres de cabeza contra una pared gigante de cloruro de litio), la atracción entre los cationes y los aniones continuará con frecuencia manteniendo el cristal unido.
Sin embargo, digamos que realmente quieres romper un compuesto iónico. Aunque son muy duros, los compuestos iónicos también suelen ser muy frágiles, lo que significa que se rompen cuando se aplica la fuerza adecuada. Como muestra la siguiente figura, el lugar en el que se aplica la fuerza es tan importante como la cantidad de fuerza que se utiliza.

Figura 8.5Aplicando una fuerza que separe los cationes y los aniones: se puede hacer que un cristal se rompa completamente.
Como se puede ver en este diagrama, los cristales iónicos se alinean de tal manera que hay regiones donde una pequeña fuerza puede romper el cristal. Estas regiones se denominan a veces «planos de clivaje» porque son los lugares donde el cristal es más débil y puede romperse más fácilmente.
Los compuestos iónicos conducen la electricidad cuando se disuelven en agua o se funden
Érase una vez un inventor que ideó un aparato para secar el pelo. Este «secador de pelo», como él lo llamaba, calentaba el aire con electricidad y lo hacía pasar por el cabello de la persona que lo sostenía. Como el agua se evapora al calentarse, el pelo se secaba más rápidamente. El legado de este inventor perdura hasta nuestros días en un electrodoméstico amado por millones de personas.
Los electrolitos son compuestos que conducen la electricidad cuando se disuelven en agua. Muchos compuestos iónicos se consideran electrolitos. Sin embargo, algunos compuestos iónicos no se disuelven en agua. Como resultado, no comparten esta propiedad.
Poco después, hubo un tipo que decidió que no quería esperar a salir de la bañera para secarse el pelo. Su legado: Una pegatina de advertencia del secador de pelo con la imagen de un tipo electrocutado.
Cuando los compuestos iónicos se colocan en el agua, hacen que ésta conduzca la electricidad. Normalmente, el agua no conduce bien la electricidad. Sin embargo, cuando las sales se disuelven en el agua, se descomponen en los cationes y aniones que las componen y es la presencia de estos iones lo que permite que conduzca la electricidad. Dado que las sales conducen la electricidad cuando se disuelven en el agua, se las denomina electrolitos.
De la misma manera, las sales puras también conducen la electricidad cuando se funden. Como sólido, los aniones y cationes de un compuesto iónico están bloqueados y no pueden mover la carga eléctrica. Sin embargo, cuando el compuesto iónico se funde, estos iones son libres de moverse y conducir la carga.
Extraído de The Complete Idiot’s Guide to Chemistry 2003 por Ian Guch. Todos los derechos reservados, incluido el derecho de reproducción total o parcial en cualquier forma. Utilizado por acuerdo con Alpha Books, miembro de Penguin Group (USA) Inc.
Para pedir este libro directamente a la editorial, visite el sitio web de Penguin USA o llame al 1-800-253-6476. También puede adquirir este libro en Amazon.com y Barnes & Noble.