XeF2 es una abreviatura del compuesto químico Difluoruro de Xenón. Es un potente agente fluorante y oxidante. Además del XeF2, existen otros compuestos de xenón como el XeF4 (tetrafluoruro de xenón) y el XeF6 (hexafluoruro de xenón). De estos compuestos, el XeF2 es el más estable. Es un sólido cristalino de color blanco que se utiliza para la fluoración en procedimientos electroquímicos y laboratorios. El XeF2 tiene un olor típico nauseabundo y se descompone cuando entra en contacto con el vapor o la luz.
Es vital conocer su estructura de Lewis, hibridación y polaridad para entender las propiedades químicas así como la geometría molecular del compuesto. Así que ahora vamos a entender todas las propiedades en detalle.
Contenidos
Estructura de Lewis Xef2
La estructura de Lewis de un compuesto químico dado es crucial para conocer todas las propiedades físicas y químicas. Es una representación pictórica de todos los electrones que participan en la formación de enlaces. Esta estructura ayuda a entender las cargas de las moléculas del compuesto. Los electrones que participan en la formación de enlaces, así como los que no participan, se conocen colectivamente como electrones de valencia.
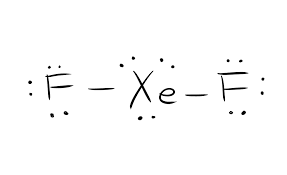
Los electrones que participan en la formación de enlaces se denominan pares de electrones de enlace. Los que no participan en la formación de enlaces se denominan pares de electrones solitarios. Para distinguir entre los diferentes tipos de electrones, tanto los pares de electrones enlazantes como los solitarios se representan de forma diferente. La formación de enlaces en el compuesto se representa como líneas rectas y los pares solitarios se representan como puntos.
La estructura de Lewis se basa en la regla del octeto. Esta regla establece que toda molécula debe tener ocho electrones en su capa exterior de un átomo para ser estable. Si hay más electrones, entonces ese compuesto dona el electrón. Mientras que si hay menos de ocho electrones, el compuesto acepta los electrones de la otra molécula para ser estable.
Así que para este compuesto XeF2, hay una molécula de Xenón y dos moléculas de Flúor. Una sola molécula de Xenón tiene ocho electrones, y una molécula de Flúor tiene siete electrones de valencia.
Número total de electrones de valencia = Nº de electrones de valencia para el Xenón + Nº de electrones de valencia para el Flúor
=8+ 7*2
=8+14
=22
El número total de electrones de valencia para el XeF2=22.
Hibridación del Xef2

La hibridación de una molécula dada es vital para entender la geometría de la molécula. Durante la formación del enlace, dos o más orbitales con diferentes niveles de energía se combinan y forman orbitales híbridos. En el XeF2, la capa exterior del xenón tiene ocho electrones, de los cuales dos participan en la formación del enlace.
El estado básico del Xenón tiene 8 electrones dispuestos en orbitales s2 p6. Mientras que en el XeF2, la molécula de Xe tiene un estado excitado. La disposición de los electrones del xenón cambia a s2 p5 d1 con dos electrones no apareados. Por lo tanto, la hibridación del átomo central Xe es sp3d. Por lo tanto la hibridación de la molécula de XeF2 es sp3d.
Geometría Molecular de Xef2

Generalmente, la estructura de Lewis es útil para entender la geometría molecular de cualquier compuesto químico. Pero como el xenón no forma enlaces fácilmente, este compuesto es un caso excepcional. La geometría molecular del difluoruro de xenón puede entenderse conociendo la teoría VSEPR. Esta teoría se basa en el número estérico del átomo central y los electrones de valencia del compuesto. VSEPR es una abreviatura de la teoría de repulsión de pares de electrones de la capa de valencia.
Aquí el número estérico del átomo central de xenón es 5. Esto significa que una sola molécula de xenón puede formar enlaces con cinco moléculas. Pero aquí en XeF2, está formando enlaces con dos átomos de flúor solamente. En el caso del xenón, dos electrones de los ocho forman enlaces con los átomos de flúor. Estos seis electrones son ahora los electrones no enlazantes. Estos tres pares de electrones solitarios se extienden en una disposición que está en la posición ecuatorial a los pares de electrones enlazados.
La forma de la molécula debería ser bipiramidal trigonal según la hibridación, pero no lo es. XeF2 es una molécula lineal debido a la disposición de los átomos de flúor y a los pares de electrones solitarios en la disposición simétrica.
Ángulo de enlace
Ahora que conocemos la geometría molecular de la molécula de difluoruro de xenón, el ángulo de enlace se puede entender fácilmente. Hay dos pares de electrones enlazados y tres pares solitarios de electrones. Los pares solitarios están en la posición ecuatorial a los pares enlazados. El ángulo de enlace entre los dos pares enlazados con el átomo central es de 180 grados, lo que hace que la geometría molecular del XeF2 sea lineal.
Polaridad del Xef2
![]()
La polaridad de cualquier molécula depende de la geometría molecular y de la hibridación del compuesto. En la molécula XeF2, dos átomos de flúor están dispuestos simétricamente en el exterior con el átomo central Xenón en el centro. No hay momento dipolar neto en el compuesto debido a la disposición de los electrones de valencia en simetría. Por lo tanto, el difluoruro de xenón es no polar ya que no se observa polaridad en la molécula.
Observaciones finales
Para resumir el artículo, se puede concluir que el XeF2 tiene 22 electrones de valencia, de los cuales hay tres pares de electrones solitarios. Su hibridación es sp3d. Según la teoría VSEPR, la geometría molecular de la molécula es lineal. El ángulo de enlace de F-Xe-F es de 180 grados. Como hay moléculas de flúor a ambos lados del átomo central, no hay momento dipolar y por lo tanto no hay polaridad. El XeF2 es no polar debido a la disposición simétrica de los pares de electrones enlazados.