La corrosion est un phénomène naturellement destructeur qui se produit lorsque certains métaux sont exposés à l’environnement. La réaction entre l’air, l’humidité et le substrat métallique donne lieu à des réactions chimiques spécifiques qui entraînent la transformation du métal en sa forme oxyde, hydroxyde ou sulfure, plus stable chimiquement. Dans les métaux à base de fer, comme l’acier, la corrosion se présente sous la forme d’oxydes de fer III, également appelés rouille.
Pour que la corrosion électrochimique se produise, trois ingrédients doivent être présents : une anode, une cathode et un électrolyte. L’anode et la cathode sont généralement reliées par un chemin électrique continu tandis que les deux sont immergées dans le même électrolyte. Au cours de ce processus, l’anode subit une corrosion, tandis que la cathode reste intacte.

Figure 1. Une cellule électrochimique typique montrant les électrons circulant de l’anode à la cathode à travers une connexion électrique. (Source : Alksub at the English Wikipedia / CC BY-SA)
Il existe différentes méthodes pour prévenir et contrôler la corrosion. L’une d’entre elles est connue sous le nom de protection cathodique (PC). Cette technique fonctionne en reliant le métal à protéger à un « métal sacrificiel » plus facilement corrodable. » Ce métal sacrificiel se corrode préférentiellement (il joue le rôle d’anode) tandis que l’objet métallique plus précieux considéré (il joue le rôle de cathode) reste protégé. Dans cet article, nous allons expliquer le fonctionnement de cette méthode de protection sacrificielle et décrire ses différentes applications.
Comprendre la corrosion galvanique ou bimétallique
Pour comprendre le fonctionnement de la protection cathodique, nous devons d’abord apprécier les bases de la corrosion bimétallique, également appelée corrosion galvanique. La corrosion bimétallique, comme son nom l’indique, est un type de corrosion unique qui se produit entre l’appariement de deux métaux. Cette corrosion est observée dans plusieurs situations où des métaux dissemblables sont en contact direct ou indirect l’un avec l’autre. La corrosion bimétallique se caractérise généralement par une corrosion accélérée d’un métal alors que l’autre n’est pas affecté. En d’autres termes, un métal se sacrifie tout en protégeant l’autre. (Ce processus est examiné plus en détail dans l’article Pourquoi deux métaux dissemblables provoquent-ils de la corrosion ?)
La corrosion dans une cellule électrochimique est principalement pilotée par une propriété appelée différence de potentiel. Cette différence de potentiel fait circuler les électrons d’un métal de la cellule (l’anode) vers l’autre métal (la cathode) tout en générant une petite quantité d’électricité dans le processus. Lorsque les électrons sortent de l’anode, une oxydation se produit, entraînant la dégradation ou la corrosion du métal anodique. Pendant ce temps, lorsque les électrons circulent vers la cathode, la réduction se produit, protégeant davantage le métal cathodique.
Dans la corrosion bimétallique, cette différence de potentiel est le résultat direct de la différence de potentiel d’électrode entre les deux métaux dissemblables. Lorsqu’un métal est immergé dans un électrolyte, il adopte un potentiel d’électrode qui représente la capacité du métal à être oxydé ou réduit. Le potentiel d’électrode de différents métaux est représenté sur une liste connue sous le nom de série galvanique. (Voir Introduction à la série galvanique : Compatibilité galvanique et corrosion pour plus d’informations). Les métaux placés plus haut sur le tableau sont considérés comme anodiques (plus électronégatifs), tandis que les métaux placés plus bas sur le tableau sont plus cathodiques (plus électropositifs). Plus les métaux en contact sont éloignés dans la série galvanique, plus la différence de potentiel entre les métaux est importante, donc plus la corrosion à l’anode est sévère.
La protection cathodique (PC) et son mode de fonctionnement
Bien que la conception des systèmes de protection cathodique puisse être sophistiquée, leur fonctionnement repose sur le concept de corrosion bimétallique ou galvanique décrit précédemment. En comprenant les principes de ce type de corrosion, nous pouvons jumeler des métaux à dessein pour faire en sorte que l’un protège cathodiquement l’autre. En d’autres termes, si nous voulons protéger une structure métallique particulière, nous pouvons créer les conditions dans lesquelles ce métal devient la cathode d’une cellule électrochimique. En connectant électriquement le métal à protéger à un métal plus anodique (électronégatif), nous pouvons nous assurer que l’anode se sacrifie en se corrodant préférentiellement à son homologue cathodique.
Dans certains cas, des sources d’énergie externes peuvent être utilisées pour fournir des électrons supplémentaires au processus électrochimique, ce qui peut augmenter l’efficacité de la protection cathodique.
Les systèmes de protection cathodique sont employés dans de nombreuses industries pour protéger un large éventail de structures dans des environnements difficiles ou agressifs. L’industrie pétrolière et gazière, en particulier, utilise des systèmes de protection cathodique pour prévenir la corrosion des pipelines de carburant, des réservoirs de stockage en acier, des plateformes offshore et des tubages de puits de pétrole. Dans l’industrie maritime, cette méthode de protection est également utilisée sur les pieux en acier, les piliers, les jetées et les coques de navires. Un autre type de protection cathodique, connu sous le nom de galvanisation, est couramment utilisé pour protéger les éléments et les structures en acier. (Pour en savoir plus, lisez La galvanisation et son efficacité dans la prévention de la corrosion.)
Types de protection cathodique (PC)
Comme mentionné précédemment, la protection cathodique fonctionne en formant intentionnellement une cellule galvanique avec un autre métal sacrificiel. Pour ce faire, on peut employer deux types distincts de protection cathodique : la protection cathodique passive et la protection cathodique à courant imposé.
Protection cathodique passive
Dans les systèmes de protection cathodique passive, l’anode sacrificielle est reliée directement ou indirectement au métal à protéger. La différence de potentiel entre les deux métaux dissemblables génère une électricité adéquate pour former une cellule électrochimique et entraîner une corrosion galvanique ou bimétallique.
Ce type de protection est couramment utilisé dans l’industrie pétrolière et gazière pour protéger les éléments structurels en acier des plates-formes et des plateformes offshore. Ici, des barres d’aluminium (ou un autre métal approprié) sont montées directement sur les sections en acier pour assumer le rôle du métal sacrificiel. Les chauffe-eau, les réservoirs et les pieux en acier sont également protégés par cathode en utilisant une méthode similaire.
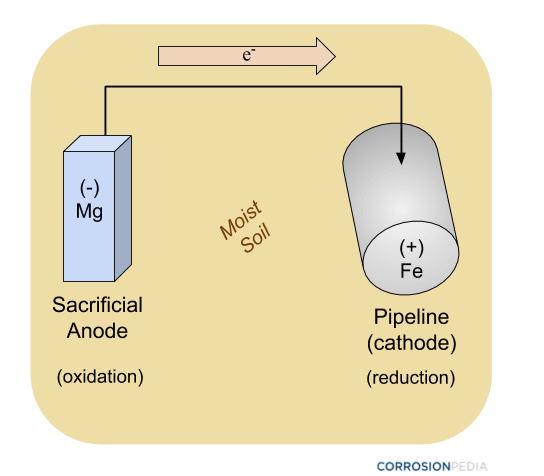
Figure 2. Schéma d’un pipeline étant protégé par une anode sacrificielle utilisant des méthodes de protection cathodique passive. Remarquez qu’aucune source d’énergie externe n’est impliquée.
Un autre exemple courant de protection cathodique passive est l’acier galvanisé par immersion à chaud. Au cours de ce processus, les membres ou les structures en acier sont immergés dans un bain de zinc fondu qui recouvre l’objet. Lorsque l’acier est retiré du zinc fondu, il réagit avec l’air et l’humidité pour former une couche protectrice connue sous le nom de carbonate de zinc, qui crée une cellule galvanique avec l’acier.
Lorsque l’élément en acier est rayé ou endommagé, de sorte que le substrat est exposé, le revêtement de zinc environnant agit comme l’anode sacrificielle et se corrode préférentiellement pour protéger l’acier exposé. Ce type de protection se poursuit jusqu’à ce que le zinc à proximité soit épuisé.
Protection cathodique à courant imposé (ICCP)
Dans les grandes structures, il peut être impossible d’utiliser des méthodes de protection cathodique passive. Le nombre d’anodes sacrificielles nécessaires pour délivrer suffisamment de courant pour assurer une protection adéquate peut être soit irréaliste, soit peu pratique. Pour remédier à ce problème, une source d’énergie externe est utilisée pour faciliter les réactions électrochimiques. Cette technique est connue sous le nom de protection cathodique par courant imposé (ICCP). Les systèmes de protection cathodique par courant imposé sont idéaux pour protéger les structures longues, telles que les canalisations souterraines. Les brides des tuyaux de raccordement sont généralement isolées à l’aide de kits d’isolation pour séparer les tuyaux en sections plus petites et plus faciles à gérer aux fins de la protection ICCP.

Figure 3. Schéma d’un objet protégé par une anode utilisant des méthodes de protection cathodique par courant imposé (ICCP). Remarquez comment une source de courant continu externe est impliquée.
Limites de la protection cathodique
Dans les grands réseaux de pipelines, il peut y avoir de nombreux croisements, parallélismes et approches à proximité du système de PC du pipeline. Des interférences de courant continu peuvent se produire entre les pipelines, ce qui accélère la corrosion. Afin de surmonter ce problème, les pipelines peuvent être couplés électriquement, soit directement, soit par résistance.
Pour les pipelines revêtus, un décollement cathodique peut se produire en raison de niveaux élevés de CP lorsque la qualité du revêtement appliqué est mauvaise. Des températures plus élevées peuvent également favoriser le décollement cathodique. Les environnements à pH élevé sont également une préoccupation en termes de fissuration par corrosion sous contrainte.
Conclusion
La protection cathodique est une méthode de protection populaire pour prévenir la corrosion des pipelines, des plateformes pétrolières offshore et d’autres structures en acier. Cependant, pour être mise en œuvre efficacement, il est crucial de comprendre les principes de base de la corrosion bimétallique/galvanique. Le choix du bon type de système de protection cathodique dépend de plusieurs facteurs, notamment la rentabilité et la taille de la structure à protéger.
.