In 1889 stelde Svante Arrhenius de Arrhenius-vergelijking voor op basis van zijn directe waarnemingen van de plots van snelheidsconstanten ten opzichte van temperaturen:
De activeringsenergie, Ea, is de minimale energie die moleculen moeten bezitten om te reageren tot de vorming van een product. De helling van de Arrheniusplot kan worden gebruikt om de activeringsenergie te vinden. De Arrheniusplot kan ook worden gebruikt door de lijn terug te extrapoleren naar het y-uiteinde om de pre-exponentiële factor, A, te verkrijgen. Deze factor is belangrijk omdat A=p×Z, waarbij p een sterische factor is en Z de botsingsfrequentie. De pre-exponentiële of frequentiefactor houdt verband met het aantal keren dat moleculen elkaar raken in de oriëntatie die nodig is om een reactie te veroorzaken. Het is belangrijk op te merken dat de Arrhenius-vergelijking gebaseerd is op de botsingstheorie. Deze stelt dat deeltjes moeten botsen met de juiste oriëntatie en met voldoende energie. Nu we de activeringsenergie en de pre-exponentiële factor uit de Arrheniusplot hebben verkregen, kunnen we de snelheidsconstante bij elke temperatuur met behulp van de Arrheniusvergelijking oplossen.
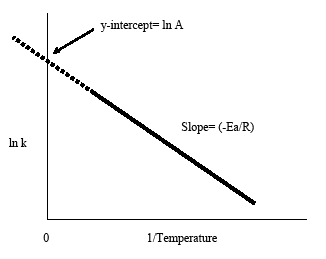
De Arrheniusplot wordt verkregen door de logaritme van de snelheidsconstante, k, uit te zetten tegen de inverse temperatuur, 1/T. De resulterende lijn met negatieve helling is nuttig voor het vinden van de ontbrekende componenten van de Arrhenius-vergelijking. Extrapolatie van de lijn naar het y-uiteinde levert de waarde op voor ln A. De helling van de lijn is gelijk aan de negatieve activeringsenergie gedeeld door de gasconstante, R. Als vuistregel geldt bij de meeste biologische en chemische reacties dat de reactiesnelheid verdubbelt als de temperatuur met elke 10 graden Celsius toeneemt.
Als we naar de Arrhenius-vergelijking kijken, bevat de noemer van de exponentiële functie de gasconstante, R, en de temperatuur, T. Dit is alleen het geval als we te maken hebben met mol van een stof, omdat R de eenheden J/molK heeft. Wanneer we te maken hebben met moleculen van een stof, wordt de gasconstante in de dominator van de exponentiële functie van de Arrhenius-vergelijking vervangen door de constante van Boltzmann, kB. De constante van Boltzmann heeft de eenheid J/K. Bij kamertemperatuur is kBT de beschikbare energie voor een molecuul bij 25 C of 273 K, en is gelijk aan ongeveer 200 golfgetallen.
Het is belangrijk op te merken dat de beslissing om de gasconstante of de Boltzmann-constante in de Arrhenius-vergelijking te gebruiken vooral afhangt van de opheffing van de eenheden. Om de inverse log van een getal te nemen, moet het getal eenheidsloos zijn. Daarom moeten alle eenheden in de exponentiële factor wegvallen. Als de activeringsenergie is uitgedrukt in joule per mol, dan moet de gasconstante worden gebruikt in de dominator. Is de activeringsenergie echter uitgedrukt in joules per molecuul, dan moet de constante K worden gebruikt.
- Arrhenius-vergelijking per mol
- Arrhenius-vergelijking per molecuul
“Gelineariseerde” Arrhenius-vergelijking
De Arrhenius-vergelijking (vergelijking \ref{eq1}) kan herschikt worden om specifieke situaties het hoofd te bieden. Door bijvoorbeeld de logaritme van beide zijden te nemen, krijgt men bovenstaande vergelijking in de vorm y=-mx+b.
Daarna kan men een plot vinden van \(\ln k\) vs. \(1/T\) en alle variabelen.
- (y=ln k\)
- (m=-Ea/RT\)
- (x=1/T\)
- (b=\ln A\)
Met deze vorm van de Arrheniusvergelijking is het eenvoudig om de helling en het y-afsnijpunt uit een Arrheniusplot te bepalen. Het is ook handig op te merken dat bovenstaande vergelijking het verband laat zien tussen temperatuur en snelheidsconstante. Naarmate de temperatuur stijgt, daalt de snelheidsconstante volgens de grafiek. Uit dit verband kunnen we afleiden dat de snelheidsconstante omgekeerd evenredig is met de temperatuur.
Geïntegreerde vorm
De geïntegreerde vorm van de Arrheniusvergelijking is ook nuttig (Vergelijking \ref{eq3}). Bij deze variant van de Arrhenius-vergelijking worden twee Arrhenius-plots op dezelfde grafiek gebruikt om de activeringsenergie te bepalen. Bovenstaande vergelijking toont het effect van de temperatuur op meerdere snelheidsconstanten. Hierdoor kan de gevoeligheid van de snelheidsconstanten voor veranderingen in activeringsenergie en temperatuur gemakkelijk worden afgeleid. Als de activeringsenergie hoog is voor een bepaald temperatuurbereik, dan is de snelheidsconstante zeer gevoelig; veranderingen in temperatuur hebben een significant effect op de snelheidsconstante. Als de activeringsenergie laag is voor een bepaald temperatuurbereik, dan is de snelheidsconstante minder gevoelig en hebben veranderingen in temperatuur weinig effect op de snelheidsconstante. Dit verschijnsel wordt in het onderstaande voorbeeld grafisch geïllustreerd:
| 1/Temp | 0.0085 | 0.0075 | 0.0065 | 0.0055 | 0.0045 | 0.0035 |
|---|---|---|---|---|---|---|
| lnk (grote Ea) | 3 | 2.5 | 2 | 1.5 | 1 | 0.0035 |
| lnk (grote Ea) | 3 | 2.5 | 2 | 1 | 0.5 | |
| lnk (kleine Ea) | 1.8 | 1.7 | 1.6 | 1.5 | 1.4 | 1.3 |
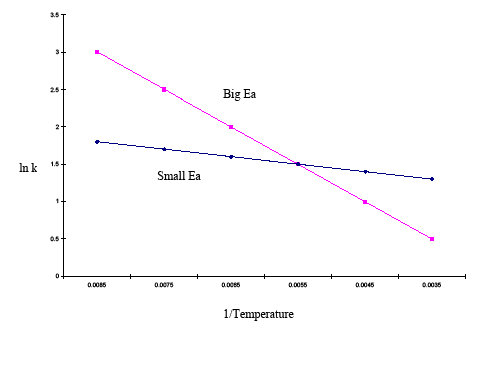
Uit bovenstaande grafiek blijkt dat de plot met de steilere helling een hogere activeringsenergie heeft en de plot met de vlakkere helling een kleinere activeringsenergie. Dit betekent dat over hetzelfde temperatuurbereik een reactie met een hogere activeringsenergie sneller verandert dan een reactie met een lagere activeringsenergie.
Biologische betekenis
De Arrhenius-plot kan niet-lineair worden als stappen bij verschillende temperaturen snelheidslimiterend worden. Een dergelijk voorbeeld is te vinden bij Fox en medewerkers in 1972 met betaglycosidetransport in E. coli. De verschillen in de overgangstemperaturen zijn te wijten aan de vetzuursamenstelling in de celmembranen. Het verschil in overgangstoestand is een gevolg van de sterke verandering van vloeibaarheid van het membraan. Een ander voorbeeld is een plotselinge daling bij lage 1/T (hoge temperaturen), een gevolg van denaturatie van eiwitten.
Kernpunten
- Arrhenius-plots tonen aan dat reactiesnelheden omgekeerd evenredig zijn met temperatuurveranderingen
- De negatieve helling uit de Arrhenius-plot geeft de activeringsenergie, Ea: helling = -Ea/R
- Extrapolatie van de Arrheniusplot terug naar het y-uiteinde geeft lnA
- De Arrheniusplot laat zien hoe activeringsenergie en temperatuur de gevoeligheid van de reactiesnelheid beïnvloeden
Oefenopgaven
1. T/F De Ea berekend uit de Arrheniusvergelijking geeft een exacte waarde.
2. Beschrijf het verband tussen temperatuur en Ea en geef voorbeelden.
3. Gebruik de volgende gegevens:
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8,314 J mol/K
Bereken k bij 27° C met de juiste eenheden.
4. Bereken k bij 37° C met de juiste eenheden met behulp van de gegevens uit opgave 3.
5. Los met behulp van de geïntegreerde vergelijking Ea op met:
k1=7,78×10-7 bij T1=273 K
k2=3,46×10-5 bij T2=298 K
Answers
- False: Ea is een gemiddelde of “schijnbare” waarde.
- Als de temperatuur toeneemt, neemt de snelheidsconstante af als de bovenstaande vergelijking wordt uitgezet. Hetzelfde geldt wanneer de temperatuur daalt, de snelheidsconstante stijgt. Uit dit verband volgt dat de snelheidsconstante omgekeerd evenredig is met de temperatuur.
- k= 8,727 sec-1
- k=23,02 sec-1
- Ea=1.026×105 J/mol
Bijdragers en toeschrijvingen
- David Johns en Andra Hutton (UC Davis)