feiten, Samenvatting & Definitie
- Allosterische enzymen zijn enzymen die een extra plaats hebben voor een effector om zich aan te binden, naast de actieve site
- Effectoren reguleren de activiteit van het enzym – ze kunnen activeren of remmen
- Allosterische enzymen zijn groter en complexer dan normale enzymen
- Ze worden gereguleerd via homotrope regulatie of heterotrope regulatie
Wat zijn allosterische enzymen?
Je zult je herinneren dat enzymen worden geclassificeerd als biologische katalysatoren. Dat wil zeggen dat ze helpen de snelheid van een reactie te versnellen, maar gedurende het hele proces onveranderd blijven.
Allosterische enzymen zijn enzymen die naast de actieve plaats nog een extra plaats hebben – het komt van het Griekse ‘allo’, dat ‘ander’ betekent. Dit worden allosterische sites genoemd, en enzymen kunnen er meer dan één hebben. Ze zijn uniek in die zin dat ze het vermogen hebben om te reageren op meerdere verschillende omstandigheden in hun onmiddellijke omgeving. Wanneer allosterische enzymen in een grafiek worden afgebeeld als snelheid tegen substraatconcentratie, vertonen zij een sigmoïdekromme in plaats van de gebruikelijke hyperparabolische kromme.
Het plaatje hieronder toont een generiek allosterisch enzym.

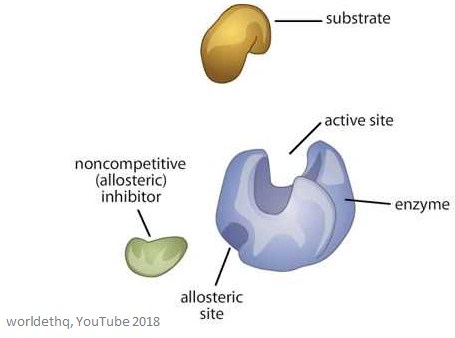
Eigenschappen van allosterische enzymen
Allosterische plaatsen zijn bindingsplaatsen op het enzym – ze zijn verschillend van de actieve plaats en de substraatbindingsplaats.
Het molecuul dat aan de allosterische plaats bindt wordt een effector genoemd (het kan ook een modulator worden genoemd), en het reguleert de activiteit van het enzym waaraan het bindt.
De activiteit van het enzym wordt verhoogd wanneer een positieve allosterische effector aan de allosterische plaats bindt. De activiteit van het enzym neemt af wanneer een negatieve allosterische effector zich aan de allosterische plaats bindt – zij remmen het enzym.
Allosterische enzymen zijn groter en complexer dan niet-allosterische enzymen en hebben vaak veel subeenheden. Enzymen met meer dan één effector hebben voor elk ervan verschillende en specifieke bindingsplaatsen. Bij de meeste allosterische enzymen bevinden de substraatbindingsplaats en de effectorbindingsplaats zich op verschillende subeenheden.
De substraatbindingsplaats bevindt zich op de katalytische subeenheid – vaak de C-subeenheid genoemd.
Wanneer een effector molecuul op een bindingsplaats een conformatieverandering in die subeenheid veroorzaakt, wordt vervolgens een conformatieverandering in de andere subeenheden in het eiwit veroorzaakt – dit betekent dat een enorm deel van de bindingsenergie van de effector wordt gebruikt om de conformatie van het gehele eiwitcomplex te veranderen.
Deze interactie tussen alle subeenheden kan worden uitgedrukt met behulp van de Hill coëfficiënt – dit wordt ook wel coëfficiënt van coöperativiteit genoemd. Wanneer n=1, zal er geen interactie zijn tussen de subeenheden in het enzym. Hoe groter de Hill coëfficiënt (coëfficiënt van coöperativiteit), hoe sterker de interacties tussen alle subeenheden in het enzym.
Allosterische enzymen kunnen ook “schakelen” tussen hun actieve vorm en hun inactieve vorm. Dit maakt verfijnde reactiepatronen in activiteit mogelijk, die een enorme rol kunnen spelen in de biologische functie. Zodra de effector loskomt van de bindingsplaats, kan het enzym terugkeren naar zijn inactieve (of minder actieve) vorm. Zij kunnen de snelheid van zeer belangrijke reacties, zoals de ATP-productie, regelen.
Wanneer een effector zich aan een enzym bindt, spreekt men van coöperatieve binding.
Homotrope regulatie
Een homotrope allosterische effector is zowel een substraat voor het enzym, als een regulerend molecuul – het voorvoegsel ‘homo’ duidt erop dat ze hetzelfde zijn. Het zijn meestal activatoren van het enzym. Onderstaande afbeelding toont een homotrope allosterische effector.

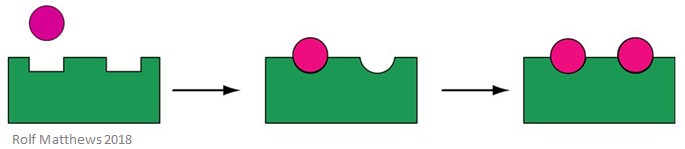
Een goed voorbeeld van een homotrope allosterische effector is zuurstof (O2) – het fungeert als een effector van hemoglobine in het menselijk lichaam.
Heterotrope regulatie
Een heterotrope allosterische effector is een regulerende molecule die niet tevens het substraat voor het enzym is. Het kan het enzym waaraan het bindt activeren of afremmen. Onderstaande afbeelding toont een heterotrope allosterische effector.

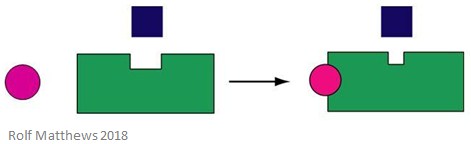
Een goed voorbeeld van een heterotrope allosterische effector is kooldioxide (CO2) – dit werkt ook als een effector van hemoglobine, maar is geen substraat van het enzym.
Essentiële activatoren
Essentiële activatoren zijn allosterische activatoren die, zonder welke, de enzymactiviteit zo laag zou zijn dat ze te verwaarlozen zou zijn. N-acetylglutamaat is bijvoorbeeld een essentiële activator voor carbamoylfosfaatsynthetase I. Zij zijn precies het tegenovergestelde van enzymremmers.