Litmuspapier is het meest erkende lid van de chemische indicatoren. Zoals de meeste pH-papieren, verandert lakmoes van kleur bij blootstelling aan een zure of basische oplossing. De eenvoudige pH-schaal loopt van 0-14, waarbij 0 de zuurste, 7 de neutraalste en 14 de meest basische of alkalische oplossing is. Lakmoespapier wordt vaak gebruikt in wetenschapslessen. Omdat het zo’n brede bekendheid geniet, is het ook een culturele referentie in onze samenleving geworden. Het is gebruikelijk om de term lakmoesproef te gebruiken voor een test waarbij één enkele factor de uitkomst bepaalt.
Achtergrond
Lakmoespapier geeft een waarnemer de mogelijkheid de pH van een monster te beoordelen. pH is een manier om de relatieve zure of basische aard van een stof te karakteriseren op basis van de waterstofionenconcentratie. Een ion is een atoom dat een elektrische lading draagt en daarom reactief is met zijn omgeving. Een zure stof geeft waterstofionen (H+) af in water. Zuren staan bekend als proton-donoren omdat het H+ ion één extra positief geladen proton heeft dat zich probeert te stabiliseren door zich te binden met een negatief geladen ion. Een basische stof geeft een hydroxide-ion (OH-) af in water. Basen worden proton-acceptoren genoemd omdat het hydroxide-ion een proton accepteert om zichzelf te stabiliseren. Interessant genoeg is het zo dat wanneer zuren en basen worden gecombineerd, het resultaat een neutraal zout is. Bijvoorbeeld, een sterk zuur zoals zoutzuur gecombineerd met natriumhydroxide (een sterke base) resulteert in een neutralisatiereactie met de bijproducten natriumchloride (keukenzout) en water.
pH is een belangrijke biologische indicator omdat de meeste levensvormen een zeer klein pH-bereik hebben waarbinnen zij kunnen overleven. Bijvoorbeeld, de zuur-base verhouding in het menselijk lichaam is een delicaat evenwicht. Zelfs een kleine verandering in de pH-waarde van het bloed in beide richtingen kan de dood tot gevolg hebben. Planten zijn ook gevoelig voor minieme pH-veranderingen in de bodem. Daarom wordt grond die te zuur is voor een plant geneutraliseerd met calciumcarbonaatmeststof, een base.
De eenvoudige pH-schaal loopt van 0-14, waarbij 7 neutraal is. Getallen lager dan 7 worden als zuur beschouwd en getallen hoger dan 7 als basisch. Hoe kleiner het getal, des te zuurder de oplossing. Dit betekent dat een stof met een pH van 1 een groter vermogen heeft om een proton af te staan aan een ander molecuul of ion dan een stof met een pH van 4. Zo is bijvoorbeeld zwavelzuur zeer effectief in het overdragen van een hydroxide-ion, terwijl azijnzuur (azijn) dat niet is. Daarom wordt zwavelzuur beschouwd als een sterk zuur en azijnzuur als een zwak zuur. Op dezelfde manier zijn er ook sterke en zwakke basen. Een sterke base zoals kaliumhydroxide, met zijn meer overvloedige hydroxide-ionen, zal gemakkelijker protonen aanvaarden dan een zwakke base zoals ammoniak. Hoe groter het aantal, hoe sterker de base.
Weliswaar is lakmoespapier doeltreffend om aan te geven of een stof zuur of basisch is, maar het kan geen exacte numerieke pH-waarde aangeven. Universele indicatoren of pH-meters worden voor dit doel gebruikt. Universele indicatoren zijn samengesteld uit een verscheidenheid van materialen, die elk verschillende kleuren bij verschillende pH-waarden veranderen, die de waarnemer toestaan om nauwkeuriger te bepalen waar de oplossing in kwestie op de pH-schaal valt. Universele indicatoren kunnen op papier worden geïmpregneerd en tot pH-papier worden verwerkt of zij kunnen in vloeibare vorm worden gebruikt. Een verwijzingskleurenkaart wordt verstrekt met elke universele indicator die een bepaalde kleur met een pH waaier correleert. Over het algemeen zijn de meeste universele indicatoren nauwkeurig tot binnen twee waarden op de pH-schaal. Een groen resultaat kan bijvoorbeeld wijzen op een pH van 8-9. Dit betekent dat universele indicatoren de pH van een monster kwantitatief binnen een bepaald bereik kunnen bepalen.
pH-meters maken een nog nauwkeurigere kwantificering mogelijk door elektriciteit te gebruiken om een numerieke pH-waarde te bepalen. Een sonde wordt in het te testen monster geplaatst en een stroom van elektriciteit vloeit door de sonde. Aangezien elektriciteit bestaat uit elektronen, die een negatieve lading hebben, is de kracht van de stroom die door de meter vloeit recht evenredig met de waterstofionenconcentratie. Hoe meer H+ ionen in de oplossing, hoe meer stroom door de meter zal vloeien. Dit getal wordt vervolgens omgezet in een numerieke pH-waarde die door de waarnemer kan worden afgelezen.
Geschiedenis
De term lakmoes komt van een Oud-Noors woord dat “verven of kleuren” betekent. Dit is toepasselijk omdat de korstmossen die voor het maken van lakmoes worden gebruikt, ook al honderden jaren worden gebruikt voor het verven van stoffen. Er is zeer weinig informatie beschikbaar over het ontstaan van lakmoes. Er zijn enkele gegevens die erop wijzen dat lakmoespapier werd ontwikkeld door J.L. Gay-Lussac, een Franse chemicus in het begin van de jaren 1800. Gay-Lussac is vooral bekend om zijn Wet van de Samengaande Volumes, die stelt dat wanneer gassen worden gevormd of met elkaar reageren bij een constante temperatuur en druk, hun volumes in kleine gehele getallen verhoudingen zijn. Met andere woorden, wanneer gassen zich met elkaar verbinden, doen zij dat altijd op dezelfde manier, mits de temperatuur en de druk gelijk blijven.
Grondstoffen
De voornaamste grondstoffen voor het maken van lakmoespapier zijn houtcellulose, korstmossen, en hulpstoffen. Lakmoespapier bestaat, zoals de naam al aangeeft, voornamelijk uit papier. Het papier dat voor de vervaardiging van lakmoespapier wordt gebruikt, moet vrij zijn van verontreinigingen die de pH van het te meten systeem zouden kunnen veranderen. Zoals het meeste papier wordt lakmoespapier gemaakt van houtcellulose. Vóór de fabricage van het papier wordt het hout met oplosmiddelen behandeld om hars en lignine uit het hout te verwijderen. Een van de meest gebruikte oplosmiddelen in de Verenigde Staten is een sulfaat – hetzij natriumsulfaat of magnesiumsulfaat.
De eigenschap van lakmoespapier om van kleur te veranderen bij blootstelling aan een zuur of een base is een gevolg van het feit dat lakmoespapier is doordrenkt met korstmossen. In de plantenwereld zijn korstmossen uniek in die zin dat zij eigenlijk twee verschillende organismen zijn, een schimmel en een alg, die als één leven. Botanici classificeren korstmossen als schimmels omdat het de schimmels zijn die verantwoordelijk worden geacht voor de geslachtelijke voortplanting. Elk korstmos heeft echter zijn eigen aparte naam. Er zijn ongeveer 15.000 verschillende soorten korstmossen geïdentificeerd. Korstmossen groeien op rotsen, bomen en muren, in de bodem en zelfs onder water in vrijwel alle klimaatsoorten. Korstmossen worden vaak gebruikt als graadmeter voor de milieukwaliteit omdat ze gevoelig zijn voor diverse verontreinigende stoffen. Verschillende soorten korstmossen worden gebruikt om lakmoes te produceren, waaronder rocella tinctoria, een inheemse soort uit het Middellandse-Zeegebied, en lecanora tartarea, een korstmos die in Nederland veel voorkomt. Nederland is zelfs een van de grootste producenten van lakmoespapier.
Ontwerp
Het meeste lakmoespapier en andere soorten pH-indicatoren worden verkocht via wetenschappelijke toeleveringsbedrijven. Lakmoespapier is verkrijgbaar in zowel rode als blauwe variëteiten. De natuurlijke kleur van lakmoespapier is blauw. Wanneer het in een zure oplossing wordt gebracht, wordt het blauwe papier rood. Rood lakmoespapier wordt bij de fabricage eerst gemengd met een zuur. Hierdoor wordt het papier rood. Wanneer het papier in de aanwezigheid van een base wordt gebracht, krijgt het zijn natuurlijke blauwe kleur terug.
Het fabricageproces
De produktie van lakmoespapier heeft veel kenmerken gemeen met de papierfabricage. In dit proces wordt de houtpulp omgezet in papier, het papier wordt doordrenkt met de korstmosoplossing, en het papier wordt gedroogd en verpakt.
Houtpulp omzetten
- 1 In deze eerste stap wordt hout versnipperd en onder stoomdruk vermengd met een oplosmiddel en water. De resulterende massa wordt houtpulp genoemd. De pulp wordt uitgespreid op een band van gaas en over rollen geleid. Hierdoor ontstaat
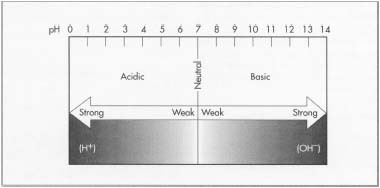 De pH-schaal.
De pH-schaal.een dunne laag die kan worden gedroogd en tot bruikbaar papier verwerkt. Een houten kist onder de band vangt het wegstromende water op. Omdat dit water bruikbare vezels bevat, wordt het opnieuw met de pulp vermengd.
- 2 Om het droogproces te versnellen, wordt gebruik gemaakt van luchtzuigpompen onder de band. Terwijl het papier langs de band beweegt, passeert het onder een gaas- of draadcilinder, een dandy roll genaamd. Het doel van de dandy roll is het papier een weef- of watermerk te geven dat de papierkwaliteit en de fabrikant identificeert. Het papier vervolgt zijn weg over de transportband, waar het tussen twee met vilt beklede rollen (couching rollen) wordt geperst, die de vezels dwingen samen te binden door extra water uit te persen.
- 3 Vanaf deze rollen wordt het papier door twee gladde metalen perswalsen geduwd, waardoor het papier een gladde afwerking krijgt. Het papier wordt volledig gedroogd door het op verwarmde rollen te leggen, gesneden door draaiende snijmachines en op spoelen gewikkeld.
Infusie van korstmossen
- 4 Om het papier pH-actief te maken, wordt het vervolgens geïnfuseerd met een waterige oplossing die grotendeels uit korstmossen bestaat. Dit wordt gedaan door het papier door een bad van de oplossing te laten lopen. Het absorbeert de oplossing en wordt dan gepasseerd om het te laten gisten en drogen.
- 5 Men laat de korstmossen gisten in aanwezigheid van kaliumcarbonaat en ammoniak. Na de gisting heeft de massa een blauwe kleur en wordt vervolgens vermengd met krijt. Blauw lakmoespapier wordt bereid door wit papier te doordrenken met een aftreksel van bovengenoemd lakmoesmengsel. Het papier wordt vervolgens zorgvuldig gedroogd in de open lucht. Rood lakmoes wordt op soortgelijke wijze bereid, maar er wordt een klein percentage zwavelzuur of zoutzuur toegevoegd om het rood te doen kleuren.
Verpakking
- 6 Nadat het papier is bereid, wordt het naar een eindverpakkingsstation gezonden. Lakmoespapier wordt meestal verkocht in voorgesneden stroken. Fabrikanten plaatsen de strips in hersluitbare plastic flesjes. Het is belangrijk dat de verpakking voorkomt dat de stroken aan vocht worden blootgesteld, aangezien elke vloeistof die met het lakmoespapier in contact komt, de indicator van kleur kan doen veranderen. Het is mogelijk, hoewel niet zo gebruikelijk, lakmoespapier te kopen op rollen die door de gebruiker kunnen worden afgesneden. Fabrikanten leveren ook schriftelijke aanwijzingen bij elke verpakking lakmoespapier, zodat de gebruiker weet hoe hij het product correct moet gebruiken. In het geval van universeel indicatorpapier of universele oplossingen zijn schriftelijke instructies niet voldoende. Er wordt ook een kleurenreferentiekaart meegeleverd, zodat de gebruiker het testresultaat kan vergelijken met de referentiekaart om de pH te bepalen.
De toekomst
Lakmoespapier zal door zijn redelijke kostprijs en gebruiksgemak zeker ook in het onderwijs veel gebruikt blijven worden. Sommige soorten korstmossen zijn echter aan het uitsterven. Als gevolg daarvan is het mogelijk dat fabrikanten van lakmoespapier in de toekomst overschakelen op synthetische materialen. Dit wordt reeds gedaan door fabrikanten van andere soorten pH-papier. Bovendien kan lakmoespapier, omdat het geen kwantitatieve resultaten kan geven, andere pH-papiertjes en pH-meters niet vervangen. In feite is de trend om pH-indicatoren te maken die nog nauwkeuriger en minder subjectief zijn. Een van die trends is het gebruik van glasvezel probes in pH-meters om ze nog gevoeliger te maken.
Waar vindt u meer informatie
Boeken
Brady, George S. Materials Handbook. 14e editie. New York: McGraw Hill, 1997.
Daub, William G., and William S. Seese. Basischemie. 7e editie. Upper Saddle, NJ: Prentice Hall, 1996.
LaRoe, Edward T. Our Living Resources. Washington, DC: U.S. Department of Interior-National Biological Service, 1995.
“Lichen.” In Van Nostrand’s Scientific Encyclopedia. 8e editie. New York: Douglas M. Considine, 1995.
Overig
Botanical.com . http://www.botanical.com (januari 2001).
Hanna Instruments Online. http://www.hannainst.com (Januari 2001).
Kiwi Web Chemistry and New Zealand. http://www.chemistry.co.nz (januari 2001).
Precision Labs. 9889 Crescent Park Drive Westchester, OH. (513) 777-3034.
– Sandy Delisle en
Perry Romanowski