Inleiding
Sinds de eerste klinische beschrijving van reumatoïde artritis (RA), heeft pannus een sleutelrol gespeeld in de ontwikkeling van de ziekte en het begrip ervan is verbeterd samen met de ontwikkeling van histologische, moleculaire biologie, en beeldvormingstechnieken.
In de kliniek wordt pannus beschouwd als een late, inactieve en irreversibele manifestatie van de ziekte, hoewel de term zuiver histologisch is. De verwarring wordt steeds duidelijker bij de klinische opvolging van RA en het gebruik van termen als pannus, synovitis, of chronische synovitis, met een vaag idee over de activiteit van de ziekte.
Voor deze review werd een literatuuronderzoek uitgevoerd in Pubmed en Embase, met de termen pannus, reumatoïde artritis, ultrasonografie, magnetische resonantie, van 1900 tot 2015. Niet-geïndexeerde teksten en boeken over het onderwerp werden doorzocht, om een verhalende en historische beschrijving te maken over pannus, zijn ontwikkeling, en zijn pathologische rol bij RA.
De eerste klinische en histologische beschrijving van pannus bij reumatoïde artritis
Hoewel soortgelijke termen als RA al vóór 1859 werden gebruikt, was het Garrod (Fig. 1) die in hoofdstuk XV van zijn boek “The nature and treatment of gout and rheumaticgout “1,2 de ziekte nauwkeurig beschreef zoals wij ze vandaag kennen, en ze onderscheidde van jicht en reumatische koorts. Hij gaf gedetailleerde illustraties (Fig. 2) van de typische misvormingen en onderstreepte het ernstige karakter van de ziekte in vergelijking met andere aandoeningen, vanwege de moeilijkheid om de ziekte onder controle te krijgen en het invaliderende klinische verloop ervan (Fig. 3).

Foto van Sir. Alfred Baring Garrod, 1819-1907.3
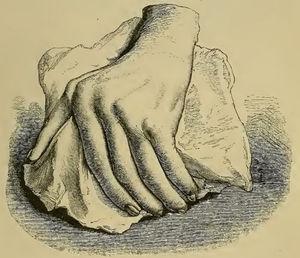
Illustratie uit Garrod’s boek met een afbeelding van een misvormde hand met ulnaire deviatie als gevolg van reumatoïde artritis.1,2
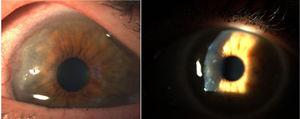
Corneale pannus.8
Ondanks een zeer grondige klinische beschrijving van RA, verzuimde Garrod de gewrichtsbetrokkenheid vanuit histopathologisch oogpunt te vermelden. Tientallen jaren later probeerde William Ord, een arts in het St. Thomas’s Hospital in Londen, in zijn manuscript dat in 1880 in het British Medical Journal werd gepubliceerd, enkele twijfels weg te nemen over de term RA die, zoals hij opmerkte, vaak op een niet-specifieke manier werd gebruikt om verschillende ziekten te classificeren. Ord stelde voor de term RA alleen te gebruiken voor het type van inflammatoire gewrichtsbetrokkenheid met effusie, verschillend van jicht, reumatische koorts (reuma), of scrofula, die gekenmerkt wordt door bot- en kraakbeenatrofie, naast synoviale hypertrofie. Deze verklaring wees op een verband met de pathofysiogenese van RA.4
In 1905 en 1909 brachten Nichols en Richardson in hun werk gepubliceerd in respectievelijk de Journal of Medical Research en de Boston Medical and Surgical Journal5 één van de beste klinisch-pathologische beschrijvingen van reumatische aandoeningen naar voren, en onderscheidden 2 groepen patiënten: één met de klinische kenmerken vergelijkbaar met RA en de andere met de kenmerken van osteoartritis.6 Niettegenstaande het feit dat beide artikels van Nichols en Richardson verwijzen naar gevallen van niet-kraakbeenachtige vervormende artritis, geeft de grondige weergave van de klinische manifestaties, vergezeld van foto’s en radiografische beelden, duidelijk de gevallen van RA weer. Deze auteurs verzamelden ook een aantal histologische specimens van 75 klinische gevallen, en kwamen tot een belangrijke conclusie: er zijn 2 histologische patronen van gewrichtsbetrokkenheid, één van verslechtering van het gewrichtskraakbeen, en het andere van verdikking van het synoviale membraan. Dit laatste is nauw verbonden met de invasie van het botweefsel en het gewrichtskraakbeen, waardoor vernietiging optreedt en soms een ongeorganiseerde botneoformatie. In dezelfde publicatie van Nichols en Richardson wordt een beschrijving gegeven van proliferatieve artritis met zeer gevasculariseerde granulatieweefselvorming, met een celcomponent van mesenchymale oorsprong, voornamelijk van het synoviale membraan en van het zogenoemde pannusachtige weefsel. Dit is de eerste keer dat de term articulaire pannus werd gebruikt.5 Er zij op gewezen dat de term pannus toen reeds in de oogheelkunde werd gebruikt om een soort hoornvliesletsels te beschrijven, en door de American Academy of Ophthalmology werd gedefinieerd als vezelige en vasculaire weefselgroei tussen het epitheel en het membraan van Bowman, vaak aanwezig in gevallen van chronisch hoornvliesoedeem, ten gevolge van de ontsteking van het hoornvlies7 (Fig. 7). In beide gevallen, synoviale pannus en corneale pannus, lijken de beschreven laesies op een pannus, het Latijnse woord voor “doek”.
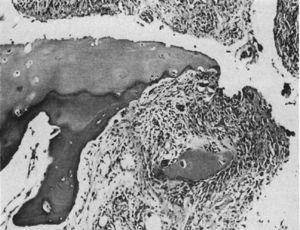
Lichtmicroscopische histologie. Destructieve laesie aan de rand van het interfalangeale gewricht. Het synoviale weefsel of pannus kan worden gezien naast het granulatieweefsel – de zogenaamde klembeweging die een fragment van het kraakbeen, gemarkeerd met “C”, isoleert.9
Een aantal van de afbeeldingen en beschrijvingen in de studie van Nichols en Richardson uit 19095 zijn afgebeeld in Figs. 4-6.
Lichtmicroscopische foto van de distale phalanx van een patiënt die lijdt aan de ziekte die toen extreme type proliferatieve artritis werd genoemd. De foto toont de vorming van dik granulatieweefsel dat het gewrichtskraakbeen binnendringt en vernietigt.5,6
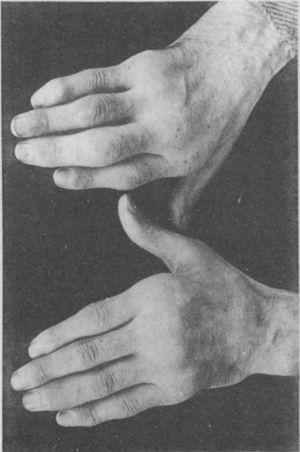
Foto van de handen van een 35-jarige patiënt met een voorgeschiedenis van gonokokken urethritis, die jaren later progressief polyartritis van de kleine en grote gewrichten ontwikkelde. Geclassificeerd als proliferatieve artritis.5,6
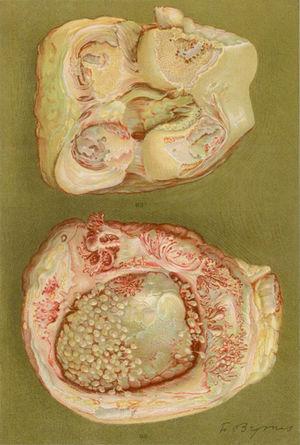
Tekening van de necropsie van een 40-jarige vrouw met een kliniek van polyartritis van de grote en kleine gewrichten leidend tot aanzienlijke invaliditeit en ankylose. Er zijn aanwijzingen voor verlies van het gewrichtskraakbeen en botvormingszones die aanleiding geven tot knie-ankylosen.5,6
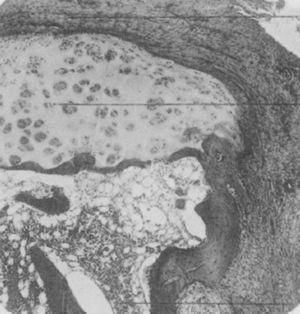
In 1959 publiceerde Kulka een overzicht van de pathogenese van RA,9 waarbij hij het werk van Nichols en Richardson5 als referentie gebruikte, waarin de histologische laesies bij RA in 3 typen werden ingedeeld: Het eerste type werd geclassificeerd als ontstekingsveranderingen van het synoviale membraan, het tweede als bindweefseldegeneratie en -necrose, en het derde als vasculaire ontstekingsinfiltratie van de arteriolen en venulen. Het eerste type letsels komt overeen met de pannus beschreven in 1909 door Nichols en Richardson, bestaande uit een synoviale verdikking die kraakbeenresorptie veroorzaakt. Kulka vond met behulp van lichtmicroscopie dat enerzijds de destructieve laesie van het kraakbeen gekenmerkt werd door de chronisch ontstoken synoviale weefselgroei – of pannus – en anderzijds dat het granulatieweefsel dat vanuit de subchondrale beenmergruimten woekerde en zich door de subchondrale plaat uitbreidde om zich aan de pannus vast te hechten en deze met een klemmende beweging omringde, kon overgaan tot het isoleren van fragmenten van het marginale kraakbeen (Fig. 7).9
Kulka definieerde in zijn artikel de histologische criteria om de diagnose RA te stellen, indien aan ten minste 3 van de 5 kenmerkende eigenschappen voldaan werd, bij afwezigheid van een andere waarschijnlijke diagnose:
-
Villaire proliferatie
-
Proliferatie van de oppervlakkige synoviale cellen, gewoonlijk palisaderend
-
Gemerkte infiltratie van ontstekingscellen (lymfocyten of plasmacellen) met een neiging tot het ontwikkelen van lymfoïde noduli
-
Compacte fibrine-afzetting
Hoewel de nadruk werd gelegd op het feit dat geen van deze specifiek was, was de combinatie van 3 of meer kenmerken in afwezigheid van andere pathologieën van aanzienlijke diagnostische waarde voor RA (Fig. 8).

Lichtmicroscopische histologie. Klassieke kniesynovitis bij RA met vlijmvlakkige hypertrofie, vasculaire infiltratie en lymfoïde knobbeltjes met een kiemcentrum in de rechterhoek.9
Elektronenmicroscopie en pannustumormodel
In 1975 voerden Kobayachi en Ziff10 elektronenmicroscopiestudies uit van pannus en de aanhechting daarvan aan het kraakbeen, om zo bij te dragen tot het begrip van gewrichtsschade. Hoewel Ziff reeds in 196011 wijzigingen van het synoviale membraan had beschreven, beschreven beide auteurs dat lysosomale proteasen zich kunnen ontwikkelen binnenin de pannus, die de mucoproteïnen in het kraakbeen afbreken en kunnen worden uitgescheiden op specifieke plaatsen, zoals de articulaire randen waar de initiële pannusproductie plaatsvindt; met andere woorden, op het grensvlak van het synoviale membraan en het articulair kraakbeen.12
Deze onderzoekers analyseerden stalen van de synoviale-kraakbeen interface bij 8 patiënten met de diagnose RA, en identificeerden 3 types van letsels: de eerste met een infiltratie van mononucleaire cellen in de vaten die het kraakbeen binnendringen, en die occasioneel celnesten of -aggregaten vormen binnenin de kraakbeenmatrix (naast plasmacellen, lymfocyten en granulocyten). Bovendien werd in deze nesten ook opgelost circulerend collageen aangetroffen, wat leidde tot de theorie van een proteolytische enzymafscheiding (Fig. 9). Het tweede type letsels komt overeen met een directe invasie in het kraakbeen van monocytaire cellen en slecht gedifferentieerde fibroblasten die zich kunnen manifesteren als fagocytair of fibroblastisch, met een amorfe cytoplasmatische granulaire inhoud met celverlengingen die de kraakbenige collageenmatrix afbreken en zichtbaar zijn binnenin de cellulaire extensies (Fig. 10). Het derde type letsel presenteert zich als een dikke laag vezelig en gevasculariseerd weefsel dat het kraakbeen bedekt en de normale vascularisatie van het gewrichtskraakbeen verstoort.

Elektronenmicroscoopbeeld toont fibroblasten met ondergedompelde lysosomen (Lys) en meerdere cytoplasmatische extensies die de kraakbeenmatrix binnendringen (Ctm).10
In de volgende 2 decennia werd de leidende rol van pannus in de pathofysiologie van gewrichtsaandoeningen bij RA niet alleen beperkt tot het beschrijven van de vernietiging van het kraakbeen. Edward Harris in 199013 publiceerde één van de meest uitgebreide reviews over de pathofysiologie van RA, waarbij hij RA in 5 types indeelde, in overeenstemming met de immunologische karakteristieken van de gewrichtsschade. Hij beschreef dat in de beginstadia (stadium 2) de niet-verdikte synovia en cytokine-gemedieerde neovascularisatie van de macrofagen14 met accumulatie van de perivasculaire lymfocyten een rol speelden.15 Zoals eerder aangetoond door Kobayashi10 met behulp van elektronenmicroscopie, activeren lymfocyten – voornamelijk T CD4+16 met schaarse T-regulatoren17 – de lokale B-lymfocyten die rijpen tot antilichaam-producerende plasmacellen in het synoviale weefsel,18 waardoor dit weefsel wordt aangetast als onderdeel van het begin en de progressie van de ziekte. Harris beweerde ook dat in meer gevorderde stadia van de ziekte (stadium 4) een overvloedige proliferatie van de synovia optrad met een tot 100-voudig normaal gewicht, wat werd geïnterpreteerd als een gedrag dat lijkt op dat van een tumor met verhoogde celactiviteit van de synoviocyten, zoals werd bevestigd in verrijkt kweekmedium waar de cellen geïsoleerd en autonoom groeiden,19 waardoor voor het eerst het model van de oncogenen in overweging werd genomen, zoals dat ook het geval is bij kanker.
Pannuscelcomponenten
Hoewel verschillende onderzoekers de verdikte weefsel- of pannuscomponent bleven bestuderen, werd geen overeenstemming bereikt over de pathogenese ervan. In 1983 bestudeerden Burmester et al.20 pannus niet-lymfocytaire cellen via monoklonale antilichamen gericht tegen macrofaag en fibroblast antigenen. Zij identificeerden 3 typen synovia-lijncellen; de eerste waren meestal (40% van het totaal) monocytaire cellen of macrofagen met fagocytisch vermogen, met Fc-receptoren en HLA DR-expressie of type II. Het tweede celtype was vergelijkbaar met monocyten, maar niet fagocytisch, met HLA-DR expressie en geen andere gevonden monocytische antigenen. De laatste gevonden cellijn was positief voor fibroblast-markers, maar zonder HLA-DR expressie of andere monocytische antigenen (tussen 20% en 40% van het totaal), hetgeen in 1987 werd bevestigd met gekloonde cellen en celculturen.21 De betekenis van deze synoviale cellen was, naast andere factoren, de activering van het proto-oncogen c-jun in antwoord op de stimulus van IL-a,22 die vergelijkbaar is met de neoplastische cellen die de collagenase expressie verhogen met het vermogen om, samen met stromelysine en andere metalloproteïnasen, het kraakbeen en de botmatrix te vernietigen,23,24 een bevinding die eerder, in 1960, aan Ziff werd toegeschreven.11
Zvaifler en Firestein25 oordeelden in 1994 dat de oorsprong van pannus onduidelijk was en dat het bewijsmateriaal verdeeld was in een chronisch ontstoken synoviaal weefsel, en een gespecialiseerd, sterk gevasculariseerd bindweefsel dat begon bij de synovia-bot interfase en historisch gedefinieerd was als de plaats van het begin van het destructieve proces.5,10,26,28 Twee mogelijkheden over de oorsprong van deze synoviocyten, die vergelijkbaar zijn met fibroblasten en de naam pannocyten kregen, werden in dit overzicht overwogen.20 De eerste hypothese was dat de onrijpe mesenchymale cellen als eerste de vaten binnendrongen die het kraakbeen binnendrongen en die konden worden vervangen o konden evolueren tot fibroblasten,27 in een proces gemedieerd door onbekende ontstekingsfactoren (factor X), onafhankelijk van immuun T-cel afgeleide factoren, zoals ook is aangetoond in diermodellen.29,30 De tweede minder ondersteunde hypothese, en gebaseerd op studies die begin jaren 90 werden uitgevoerd,31-33 was afhankelijk van de cytokines van lymfocyten en beschreef de verminderde genoomexpressie van lymfocyten en lymfocytaire producten in de weefsels en in de synoviale vloeistof (Fig. 11).

Er zijn verschillende wegen waarlangs de onbekende factor “X” bij RA de vorming van pannus zou kunnen induceren. Het kan beginnen via de T-cel afhankelijke route of via de synoviocyten route.25
De review van Zvaifler en Firestein25 probeert niet alleen het ontstaan, maar ook het voortduren van pannus te begrijpen, gebaseerd op 2 mogelijkheden: één – zoals reeds vermeld in 1989 – beschouwt een tumormodel waarin de synoviale cellen worden getransformeerd door een signaal dat proliferatie in gang zet en de expressie van oncogenen en de productie van enzymen induceert die de matrix of adhesie-eiwitten afbreken.34,35 Deze signalen kunnen afkomstig zijn van oplosbare moleculen zoals cytokinen of van niet nader omschreven etiologische agentia. Vanuit dit perspectief zijn weefsels zoals kraakbeen of bot, niet onderdeel van hun ontwikkeling, maar worden ze aangetast door pannus. De tweede mogelijkheid is gebaseerd op het idee dat verbindingen gegenereerd door chondrocyten of immuuncomplexen ondergedompeld in het kraakbeen, degenen zijn die verantwoordelijk zijn voor het activeren van de synoviocyten om het weefsel binnen te dringen en hun natuurlijke omgeving te verlaten.
Hoewel het proces waarbij de fibroblast-achtige synoviocyten, die Fc receptoren missen, worden beïnvloed door deze immuuncomplexen36 niet is vastgesteld, maar het is waarschijnlijk dat de monocytair-macrofaag cellen de tussenpersonen zijn. Een waarschijnlijke verklaring van deze gebeurtenis is de binding van complementproteïnen en immuuncomplexen aan vitronectine en zijn receptoren, die de differentiatie, migratie en proliferatie van fibroblasten beïnvloedt en die vervolgens wordt versterkt door het contact van deze cellen met collageen, fibronectine en andere metalloproteïnasen,37,38 via de expressie van receptoren zoals VCAM-1, dat tot dan toe het enige bekende adhesiemolecuul was dat tot overexpressie kwam in de fibroblastachtige synoviocyten.39
Volgens dit tweede scenario, zal het kraakbeen niet alleen het door pannus aangetaste weefsel zijn, maar ook de inducer en perpetuator van deze respons. Ondanks het bovenstaande is het nog steeds duidelijk dat de instandhouding van de pannus afhankelijk is van de cytokines die de celgroei stimuleren en van de productie van enzymen die gesynthetiseerd worden door de monocytair-afgeleide synoviocyten40 en van de fibroblast-achtige synoviocyten. Het werd in vitro aangetoond dat de enzymen werden gesynthetiseerd41 via de regulatie en bemiddeling van T-lymfocyten, monocyten, en hun bijproducten die de meeste cellen in de pannus uitmaken.42
Het werk van Burmester in 198320 was fundamenteel voor de continuïteit van de studie van de cellulaire component van de pannus. Xue’s groep in 1997 bestudeerde artroplastie specimens met pannus van patiënten met RA en observeerde PSC cellen die fenotypisch werden bestudeerd via microscopie en immunohistochemie, met een specifieke proteïne en genomische expressie.43 Deze cellen bleken positief te zijn voor vimentine filamenten, immunofluorescentie markers (Fig. 12) en waren morfologisch vergelijkbaar met fibroblasten onder de microscoop. De safranine O merker die reageert met proteoglycanen (Fig. 13), evenals de mRNA expressie van type II collageen dat gebruikt wordt om chondrocyt-achtige cellen te identificeren, waren echter ook positief; vandaar de conclusie dat deze cellen een combinatie zijn van fibroblasten en chondrocyten.
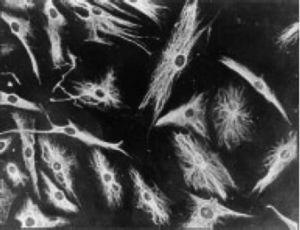
Immunofluorescentiemicrofoto waarop de positiviteit te zien is van de PSC-cellen voor anti-vimentine-antilichamen gelabeld met fluoresceïne-isothiocyanaat. Dit is vergelijkbaar met de bevindingen bij fibroblasten.43
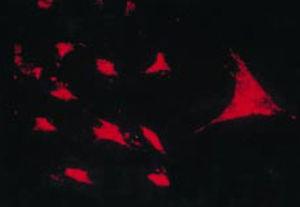
In situ reverse transcriptase assay om de expressie aan te tonen van type II collageen RNA in een PSC-cultuur, die chondrocytachtige kenmerken vertoont.43
De genoomexpressiestudie bewees ook de hoge activiteit van proto-oncogenen voor c-myc, c-jun en c-fos die de hoge productie van enzymen zoals cathepsine B en L en sommige collagenasen mogelijk maakt.
In latere jaren werden verdere bewijzen onthuld over de kenmerken van het weefsel bij vroege gewrichtsaandoeningen en de verhoogde expressie van het p53 gen,44 mutaties die vaker werden gezien in gevorderde stadia.45 In 2003 constateerden Smeets et al. verschillen in de cellulaire kenmerken, cytokine expressie, angiogene factoren en metalloproteïnasen van de pannus, verkregen uit preparaten van patiënten met late ziekte die een gewrichtsvervanging ondergingen zonder tekenen van klinische activiteit van artritis, in vergelijking met patiënten die artroscopie ondergingen en beschouwd werden als patiënten in de vroege stadia van de ziekte omdat ze nog klinische activiteit van artritis hadden.46 De verschillen tussen beide groepen waren het grotere aantal macrofagen en T-lymfocyten afkomstig van de artroscopie-specimens of van de vroege ziekte, en de hogere expressie van TNF-a, IL-6, metalloproteïnasen (MMP-1, MMP-3, MMP-13) en van de angiogenesefactor (VEGF).
Pannus wordt vaak beschouwd als een vezelig weefsel zonder belangrijke biologische activiteit en als een overblijfsel van de gewrichtsschade dat onomkeerbaar lijkt te zijn. Pannus gedraagt zich echter als een medium dat grote hoeveelheden proteolytische enzymen produceert, met een centrale pathologische rol, zoals de MMP 1, 3, 13 en 14.47 Met name MMP 3 of stromelyn (hierboven genoemd)23,24,48 wordt intensief geproduceerd, zoals in 200549 is aangetoond door mRNA detectie bij de synovium-kraakbeen junctie, en is IL-1b afhankelijk voor synthese stimulatie. MMP 3 verschilt van MMP 1 of collagenase type 1, omdat het minder talrijk is en gestimuleerd wordt door TNF-a.
Pannus en Kappa B nucleaire factor
De kappa B nucleaire transcriptiefactor (NF-kB) is een van de belangrijkste regulatoren van de genomische transcriptie van cytokinen, chemokinen, en adhesiemoleculen; het speelt een rol in kraakbeen en articulaire botafbraak,50 is verhoogd in het synoviale weefsel van zowel patiënten als diermodellen met RA,51-53 voornamelijk in de pannus-kraakbeen junctie53 waar er een groter aantal factor-producerende cellen is, in vergelijking met andere synoviale plaatsen buiten deze junctie. De relevantie van de NFkB factor in termen van gewrichtsschade blijkt niet alleen uit het toegenomen aantal cytokines, maar ook uit de osteoclastogenese – een sleutelproces in boterosie,54,55 die afhankelijk is van de myeloïde lijn en het RANK-RANKL complex,56-58 waardoor de activering, migratie en overleving van de osteoclast mogelijk wordt.59,60 RANKL is afkomstig van T-lymfocyten, fibroblast-achtige synoviocyten, en cellen buiten het pannus-bot grensvlak.50,61-63 Pettit et al., in 2006,64 onderzochten het RANKL expressiepatroon, NF-kB en osteoprotegerine (natuurlijke remmer van RANKL die zijn binding aan de receptor blokkeert en daardoor osteogenese verhindert) in pannus specimens van patiënten met RA, specifiek van het pannus-bot grensvlak waar het nog nooit was onderzocht. Het resultaat was dat zowel RANKL als osteoprotegerine tot expressie komen in micro-omgevingen waar het pannus interfereert met het bot of het kraakbeen en er erosie of weefselbeschadiging optreedt, steeds in verhoudingen die de maturatie van de osteoclast en zijn activatie begunstigen. Dit moleculaire onevenwicht werd in 2008 bekrachtigd.65
Diagnostische beelden en pannus
In 1978 toonde Cooperberg als eerste synovitis aan met echografie, waarbij hij een verdikking van het synoviale membraan van de knie vaststelde op een grijsschaalbeeld.66 Verdere details werden waargenomen in het werk van De Flaviis in 1988, die een echografisch protocol toepaste in de hand van patiënten met RA.67 Er gingen 6 jaar voorbij totdat Newman de Doppler methode gebruikte op pezen en slijmbeurzen,68 en 2 jaar later gebruikte hij het voor synoviale verdikkingen in de knieën van patiënten met RA.69 Natias Hau gebruikte in 1999, met hoge resolutie echografie, voor het eerst de Doppler mode op de pannus van handen van patiënten met RA, en toonde hypervascularisatie70 van de kniegewrichten, waarmee hij de verhoogde vascularisatie bevestigde die al beschreven was in studies die een eeuw eerder waren uitgevoerd (Fig. 14).5,12,14,15
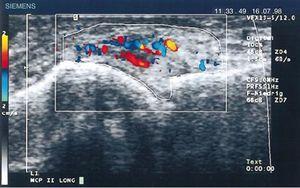
Echografie in de lengterichting van het metacarpofalangeale gewricht waarop de eerste Doppler-beelden te zien zijn met een verhoogde vascularisatie van de pannus bij een patiënt met RA.70
Na met behulp van echografie veranderingen in het synoviale weefsel te hebben aangetoond, was de volgende stap vast te stellen of dit pannus, zoals klinisch gezien, ook involutie vertoont. De eerste die dit soort echografisch onderzoek deed was Newman in 1996, toen hij met behulp van Doppler bij RA69 veranderingen constateerde in de hoeveelheid vascularisatie na intra-articulaire steroïdtherapie. Dezelfde resultaten werden gezien in het werk van Stone in 2001.71 Hij vergeleek de beelden van metacarpophalangeale gewrichten, voor en na intraveneuze methylprednisolon- of orale prednisolontherapie. Met behulp van TNF-a remmers publiceerden Hau et al. in 2002 een artikel waarin zij de veranderingen in de vascularisatie van de pannus72 bij met etanercept behandelde patiënten aantoonden, en ook in latere studies.73-76 Taylor toonde de verandering van hypervascularisatie met infliximab77 en Naredo deed hetzelfde in 2008.78
Het gebruik van magnetische resonantie dat in 1988 begon met het werk van Gilkenson toonde aan dat dit een betere methode was om handerosies bij patiënten met RA op te sporen79 ; Kusunoglu toonde in 1990 aan dat het nuttig was om synoviale verdikking te onderscheiden van gewrichtseffusie.80 Het zichtbaar maken van de pannus met behulp van deze methode begon in 1994, toen Ostergaard voor het eerst de synoviale verdikking en het verband met de activiteit van de ziekte beoordeelde,81 bevestigd door een uitgebreider werk van Sugimoto in 1998,82 en tenslotte in 2003 definieerde de OMERACT-groep synovitis in kernspinresonantie als een toename van de synoviale dikte na contrastinjectie; dit is zonder meer het bewijs van pannus.83
Conclusies
De geschiedenis heeft het mogelijk gemaakt om de kritieke rol van pannus in gewrichtsdestructie te begrijpen, die soms vergelijkbaar is met een tumorlaesie vanwege zijn snelle en overvloedige groei, die de productie van antilichamen bevordert die het auto-immuunproces bestendigen. Dit is in strijd met het idee dat pannus een nauwelijks actief granulatieweefsel is, dat beperkt is tot louter resterend littekenweefsel. Deze karakteristieken interfereren met de processen van ontwikkeling, progressie, en destructie van het gewrichtsbot en kraakbeen die al meer dan 100 jaar worden aangetoond, en bewezen met microscopie en moleculaire biologie technieken. Daarom is het idee dat pannus een definitieve of onomkeerbare aandoening is, onjuist, aangezien het geen actief onderdeel van de ziekte is, en integendeel, het kan worden omgekeerd als reactie op behandeling. Het onjuiste gebruik van de term moet worden vermeden om de klinische evaluatie van de ziekte minder verwarrend te maken. Deze veranderingen worden van oudsher toegeschreven aan synovitis, wat gewoon de ontsteking van het synoviale weefsel is die klinisch wordt beoordeeld. De term synovitis kan niet onderscheiden worden van pannus, aangezien het verwijst naar een histologische bevinding en pannus dus niet wordt opgenomen in de initiële klinische evaluatie of in de opvolging van patiënten met RA door de verschillende wetenschappelijke genootschappen.
Verder onderzoek naar pannus als een onmisbaar onderdeel van de pathogenese van RA zal bijdragen tot een beter begrip van de ziekte vanaf het allereerste begin, en nieuwe wegen openen voor de klinische of beeldvormende evaluatie ervan, naast het identificeren van meer gerichte therapieën die de vernietiging van de gewrichten afremmen.
Belangenverstrengeling
De auteurs hebben geen belangenverstrengeling bekend te maken.