Eigenschappen van Ionische verbindingen
Omdat alle ionische verbindingen worden gevormd wanneer anionen en kationen tot elkaar worden aangetrokken, hebben ionische verbindingen vaak vergelijkbare eigenschappen.
Ionische verbindingen vormen kristallen
Ionische verbindingen bestaan uit kationen en anionen die door hun tegengestelde lading naast elkaar blijven hangen. Stel je voor dat een enkel lithium-kation naast een enkel chloor-anion plakt om lithiumchloride te vormen. Nu is het onwaarschijnlijk dat er slechts één lithiumion en één chloride-ion op deze plaats aanwezig zijn, want als we het over chemische reacties hebben, hebben we het over een enorm aantal atomen dat op een zeer kleine plaats een reactie ondergaat (een theelepel zout bevat ongeveer 1022 atomen). Als gevolg hiervan zou, als ons ene LiCl-paar in de buurt van een ander LiCl-paar zou komen, het volgende gebeuren:
Omdat tegengesteld geladen ionen elkaar aantrekken, zullen de LiCl-paren de neiging hebben grotere groepen te vormen. Deze grotere groepen zullen op hun beurt nog grotere groepen ionen vormen, zoals te zien is in de volgende figuur:
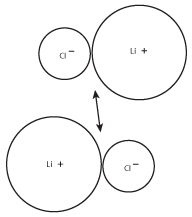
Figuur 8.3De positieve lading op het lithiumkation van het ene paar zal worden aangetrokken door de negatieve lading op het chloride-ion van het andere paar.

Figuur 8.4Dit proces, waarbij stapels LiCl-ionen zich met elkaar verbinden, gaat door totdat er geen lithium- of chloride-ionen meer zijn.
Figuur 8.44Dit proces, waarbij stapels LiCl-ionen zich met elkaar verbinden, gaat door totdat er geen lithium of chloride-ionen meer zijn.
Kristallen zijn grote rangschikkingen van ionen of atomen die in regelmatige patronen zijn gestapeld. Veel ionische verbindingen vormen zeer grote kristallen.
Deze grote opstellingen van ionen worden kristallen genoemd. Hoewel kristallen vaak gevormd worden uit ionische verbindingen, komen ze ook voor in sommige andere chemische verbindingen, zoals diamanten. Hierover meer in detail in Solids.
Hydraten worden gevormd wanneer een of meer watermoleculen zich aan ionische verbindingen hechten. Deze verbindingen zijn interessant omdat ze droog lijken, maar water afgeven bij verhitting. Bijzonder interessant is Epsomzout, of magnesiumsulfaat heptahydraat (MgSO47H2O). Bij verhitting komt er zoveel water vrij dat het magnesiumsulfaat zelfs oplost!
Ionische verbindingen hebben vaak een hoog smelt- en kookpunt
Wat gebeurt er als je iets verhit in je keuken? Misschien heb je tijdens het koken (of tijdens het opwarmen van willekeurige dingen in de magnetron terwijl je je verveelde) ontdekt dat de meeste voedingsmiddelen die we eten smelten of verbranden als ze worden verhit. Sommige voedingsmiddelen doen het zelfs allebei! Zoals u waarschijnlijk wel kunt raden, ben ik een expert als het gaat om het blussen van huisbrandjes.
Ionische verbindingen daarentegen smelten en koken vaak bij veel hogere temperaturen dan andere materialen. Om ionische verbindingen te laten smelten, moet voldoende energie worden toegevoegd om de kationen en anionen van elkaar af te bewegen. Omdat deze aantrekkingen zo sterk zijn, is er veel energie nodig om deze ionen uit elkaar te trekken. Om ionische verbindingen zoveel energie toe te voegen is veel warmte nodig, en daarom hebben ionische verbindingen een zeer hoog smelt- en kookpunt.
Ionische verbindingen zijn hard en bros
Stel je voor dat je een grote brok lithiumchloride tegen je hoofd slaat. Hoe denk je dat dat zou voelen? Als je denkt dat het ongelooflijk veel pijn zou doen, dan heb je gelijk. Net als veel ionische verbindingen is lithiumchloride keihard.
Ionische verbindingen zijn extreem hard omdat het moeilijk is om de ionen in een kristal uit elkaar te laten bewegen. Zelfs als je veel kracht op het kristal uitoefent (stel je voor dat je met je hoofd tegen een gigantische muur van lithiumchloride aanloopt), dan nog zal de aantrekkingskracht tussen de kationen en anionen het kristal vaak bij elkaar blijven houden.
Maar stel nu eens dat je een ionische verbinding echt uit elkaar wilt halen. Hoewel ze zeer hard zijn, zijn ionische verbindingen vaak ook zeer bros, wat betekent dat ze uit elkaar vallen als de juiste kracht wordt uitgeoefend. Zoals uit de volgende figuur blijkt, is het net zo belangrijk waar je kracht uitoefent als hoeveel kracht je gebruikt.

Figuur 8.5Door kracht uit te oefenen op een manier die de kationen en anionen uit elkaar houdt: kan een kristal volledig uit elkaar vallen.
Zoals je in dit diagram kunt zien, richten ionische kristallen zich zo op dat er gebieden zijn waar een kleine kracht het kristal kan doen uiteenvallen. Deze gebieden worden ook wel “splijtvlakken” genoemd, omdat het kristal daar het zwakst is en het gemakkelijkst kan worden gebroken.
Ionische verbindingen geleiden elektriciteit wanneer ze in water worden opgelost of gesmolten
Er was eens een uitvinder die een apparaat had bedacht om haar te drogen. Deze “haardroger”, zoals hij hem noemde, verwarmde lucht met elektriciteit en blies die over het haar van de persoon die hem vasthield. Omdat water verdampt wanneer het verwarmd wordt, droogde het haar sneller. De erfenis van deze uitvinder leeft tot op de dag van vandaag voort in een huishoudelijk apparaat dat bij miljoenen mensen geliefd is.
Electrolyten zijn verbindingen die elektriciteit geleiden wanneer ze in water worden opgelost. Veel ionische verbindingen worden beschouwd als elektrolyten. Sommige ionische verbindingen lossen echter niet op in water. Daardoor hebben ze deze eigenschap niet.
Kort daarna was er een man die besloot dat hij niet wilde wachten om uit bad te komen voordat hij zijn haar droogde. Zijn erfenis: Een waarschuwingssticker van een haardroger met een afbeelding van een man die geëlektrocuteerd wordt.
Wanneer ionische verbindingen in water worden geplaatst, zorgen ze ervoor dat het water elektriciteit gaat geleiden. Normaal geleidt water helemaal geen elektriciteit. Wanneer zouten echter in water oplossen, vallen zij uiteen in de kationen en anionen waaruit zij bestaan, en het is de aanwezigheid van deze ionen die ervoor zorgt dat het water elektriciteit geleidt. Omdat zouten elektriciteit geleiden wanneer zij in water zijn opgelost, worden zij elektrolyten genoemd.
Op dezelfde manier geleiden zuivere zouten ook elektriciteit wanneer zij worden gesmolten. Als vaste stof zitten de anionen en kationen in een ionische verbinding op hun plaats en kunnen ze geen elektrische lading verplaatsen. Maar wanneer de ionische verbinding wordt gesmolten, zijn deze ionen vrij om te bewegen en elektriciteit te geleiden.
Uittreksel uit The Complete Idiot’s Guide to Chemistry 2003 door Ian Guch. Alle rechten voorbehouden, inclusief het recht van gehele of gedeeltelijke reproductie in welke vorm dan ook. Gebruikt volgens afspraak met Alpha Books, een onderdeel van Penguin Group (USA) Inc.
Om dit boek rechtstreeks bij de uitgever te bestellen, bezoek de Penguin USA website of bel 1-800-253-6476. U kunt dit boek ook kopen bij Amazon.com en Barnes & Noble.