XeF2 is een afkorting voor de chemische verbinding xenon-difluoride. Het is zowel een krachtig fluoriderend als een oxiderend middel. Naast XeF2 zijn er nog andere xenonverbindingen, zoals XeF4 (xenon-tetrafluoride) en XeF6 (xenon-hexafluoride). Van deze verbindingen is XeF2 de meest stabiele. Het is een witte
kristallijne vaste stof die voor fluorideringsdoeleinden in elektrochemische procedures en laboratoria wordt gebruikt. XeF2 heeft een typische misselijkmakende geur en wordt afgebroken wanneer het in contact komt met damp of licht.
Het is van vitaal belang de Lewis-structuur, hybridisatie en polariteit te kennen om de chemische eigenschappen en de moleculaire geometrie van de verbinding te begrijpen.
Inhoud
Xef2 Lewisstructuur
De Lewisstructuur van een bepaalde chemische verbinding is van cruciaal belang om alle fysische eigenschappen en chemische eigenschappen te kennen. Het is een grafische voorstelling van alle elektronen die deelnemen aan de vorming van bindingen. Deze structuur helpt bij het begrijpen van de ladingen op de moleculen van de verbinding. De elektronen die deelnemen aan de vorming van bindingen, evenals de elektronen die daar niet aan deelnemen, staan gezamenlijk bekend als valentie-elektronen.
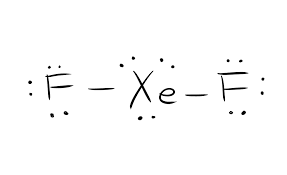
Elektronen die deelnemen aan de vorming van bindingen worden bindingsparen elektronen genoemd. De elektronen die niet deelnemen aan de vorming van bindingen worden lone elektronenparen genoemd. Om onderscheid te maken tussen de verschillende soorten elektronen, worden zowel de bindingsparen als de eenzame elektronenparen verschillend weergegeven. De bindingsvorming in de verbinding wordt weergegeven als rechte lijnen en de eenparen worden weergegeven als stippen.
De structuur van Lewis is gebaseerd op de octetregel. Deze regel stelt dat elk molecuul acht elektronen in de buitenste schil van een atoom moet hebben om stabiel te zijn. Als er meer elektronen zijn dan dat, dan staat die verbinding het elektron af. Zijn er minder dan acht elektronen, dan accepteert de verbinding de elektronen van het andere molecuul om stabiel te zijn.
Dus voor deze verbinding XeF2 is er één molecuul xenon en twee moleculen fluor. Een enkel Xenon-molecuul heeft acht valentie-elektronen, en een Fluor-molecuul heeft zeven valentie-elektronen.
Totaal aantal valentie-elektronen = aantal valentie-elektronen voor Xenon + aantal valentie-elektronen voor Fluor.
Totaal aantal valentie-elektronen = aantal valentie-elektronen voor Xenon valentie-elektronen voor Fluor
=8+ 7*2
=8+14
=22
Het totaal aantal valentie-elektronen voor XeF2=22.
Hybridisatie van Xef2

Hybridisatie van een bepaald molecuul is van vitaal belang om de geometrie van het molecuul te begrijpen. Tijdens bindingsvorming combineren twee of meer orbitalen met verschillende energieniveaus zich en maken hybride orbitalen. In XeF2 heeft de buitenste schil van xenon acht elektronen, waarvan er twee deelnemen aan de bindingsvorming.
De grondtoestand van xenon heeft 8 elektronen, gerangschikt in s2 p6-banen. Terwijl in XeF2, het Xe molecuul een aangeslagen toestand heeft. De rangschikking van de elektronen van Xenon verandert in s2 p5 d1 met twee ongepaarde elektronen. Vandaar dat de hybridisatie van het centrale atoom Xe sp3d is. De hybridisatie van het XeF2-molecuul is dus sp3d.
Xef2 Moleculaire Geometrie

In het algemeen is de Lewisstructuur nuttig om de moleculaire geometrie van een bepaalde chemische verbinding te begrijpen. Maar omdat xenon niet gemakkelijk bindingen vormt, is deze verbinding een uitzonderlijk geval. De moleculaire geometrie van xenondifluoride kan worden begrepen door de VSEPR-theorie te kennen. Deze theorie is gebaseerd op het sterische getal van het centrale atoom en de valentie-elektronen van de verbinding. VSEPR is een afkorting voor Valence Shell Electron Pair repulsion theory.
Hier is het sterische getal voor het centrale Xenon-atoom 5. Dit betekent dat een enkel molecuul Xenon bindingen kan vormen met vijf moleculen. Maar hier in XeF2, vormt het slechts bindingen met twee fluoratomen. Bij xenon vormen twee van de acht elektronen bindingen met de fluoratomen. Deze zes elektronen zijn nu de niet-bindende elektronen. Deze drie eenzame elektronenparen spreiden zich uit in een rangschikking die op de equatoriale positie ligt van de gebonden elektronenparen.
De vorm van het molecuul zou trigonaal bipyramidaal moeten zijn volgens de hybridisatie, maar dat is het niet. XeF2 is een lineair molecuul door de opstelling van de fluoratomen en de eenzame elektronenparen in de symmetrische opstelling.
Bindingshoek
Nu we de moleculaire geometrie van het xenondifluoridemolecuul kennen, kan de bindingshoek gemakkelijk worden begrepen. Er zijn twee paar gebonden elektronen en drie eenzame elektronenparen. De lone paren staan op de equatoriale positie ten opzichte van de gebonden paren. De bindingshoek tussen de twee bindingsparen met het centrale atoom is 180 graden, waardoor de moleculaire geometrie van XeF2 lineair is.
Xef2 polariteit
![]()
De polariteit van een bepaald molecuul hangt af van de moleculaire geometrie en de hybridisatie van de verbinding. In het XeF2-molecuul zijn twee fluoratomen symmetrisch gerangschikt aan de buitenkant met het centrale atoom Xenon in het midden. Er is geen netto dipoolmoment in de verbinding door de symmetrische rangschikking van de valentie-elektronen. Xenon difluoride is dus niet polair, omdat er geen polariteit in het molecuul wordt waargenomen.
Conclusie
Om het artikel samen te vatten, kan worden geconcludeerd dat XeF2 22 valentie-elektronen heeft, waarvan er drie eenzame elektronenparen zijn. De hybridisatie is sp3d. Volgens de VSEPR-theorie is de moleculaire geometrie van het molecuul lineair. De bindingshoek van F-Xe-F is 180 graden. Aangezien er fluormoleculen aan beide zijden van het centrale atoom zijn, is er geen dipoolmoment en is er dus geen polariteit. XeF2 is niet polair door de symmetrische rangschikking van de gebonden elektronenparen.