Hoe buffers werken
Zoals je hebt gezien bij het berekenen van de pH van oplossingen, is slechts een kleine hoeveelheid van een sterk zuur nodig om de pH drastisch te veranderen. Voor bepaalde experimenten, echter, is het wenselijk om een vrij constante pH te houden terwijl zuren of basen worden toegevoegd aan de oplossing, hetzij door reactie of door de experimentator. Chemici gebruiken buffers routinematig om de pH van een reactie te regelen. Biologen gebruiken buffers routinematig om de pH van een reactie te regelen. In de biologie worden buffers op velerlei manieren gebruikt, variërend van het regelen van de pH van het bloed tot het voorkomen dat de urine pijnlijk zuur wordt. Buffers werken door te reageren met een toegevoegd zuur of base om de pH te regelen. Laten we bijvoorbeeld eens kijken naar de werking van een buffer die bestaat uit de zwakke base ammoniak, NH3, en zijn geconjugeerde zuur, NH4+. WanneerHCl aan die buffer wordt toegevoegd, “zuigt” de NH3 het proton van het zuur op en wordtNH4+. Omdat dat proton in het ammoniumion opgesloten zit, verhoogt het proton de pH van de oplossing niet noemenswaardig.Wanneer NaOH aan dezelfde buffer wordt toegevoegd, staat het ammoniumion een proton aan de base af om ammoniak en water te worden.Hier dient de buffer ook om de base te neutraliseren.
Zoals uit bovenstaand voorbeeld blijkt, werkt een buffer door een sterk zuur of een sterk basisch zuur te vervangen door een zwak zuur of een zwak basisch zuur. Het proton van het sterke zuur is vervangen door ammoniumion, een zwak zuur. De sterke base OH- werd vervangen door de zwakke base ammoniak. Deze vervanging van sterke zuren en basen door zwakkere geeft buffers hun buitengewone vermogen om de pH te regelen.
Berekening van de pH van gebufferde oplossingen
Buffers moeten worden gekozen voor het juiste pH-bereik dat ze moeten regelen. Het pH-bereik van een gebufferde oplossing wordt gegeven door de Henderson-Hasselbalch-vergelijking. Voor het doel van de afleiding, zullen wij een buffer veronderstellen die uit een zuur, HA, en zijn geconjugeerde basis, A- wordt samengesteld. We weten dat de zuurdissociatieconstante pKa van het zuur wordt gegeven door deze uitdrukking:

De vergelijking kan als volgt worden herschikt:
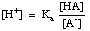
Herorden van het -log van deze uitdrukking en het positief maken van de termen geeft de vergelijking van Henderson-Hasselbalch: