Introduction
Depuis la description clinique initiale de la polyarthrite rhumatoïde (PR), le pannus a joué un rôle clé dans le développement de la maladie et sa compréhension s’est améliorée parallèlement au développement des techniques histologiques, de biologie moléculaire et d’imagerie.
En clinique, le pannus a été considéré comme une manifestation tardive, inactive et irréversible de la maladie, bien que le terme soit purement histologique. La confusion devient de plus en plus évidente lorsqu’on aborde le suivi clinique de la PR et l’utilisation de termes tels que pannus, synovite ou synovite chronique, avec une idée floue sur l’activité de la maladie.
Une recherche de la littérature dans Pubmed et Embase a été effectuée pour cette revue, en utilisant les termes pannus, polyarthrite rhumatoïde, échographie, résonance magnétique, de 1900 à 2015. Des textes non indexés et des livres sur le sujet ont été recherchés, afin de faire une description narrative et historique sur le pannus, son développement, et son rôle pathologique dans la PR.
La description clinique et histologique initiale du pannus dans la polyarthrite rhumatoïde
Bien que des termes similaires à la PR aient été utilisés avant 1859, c’est Garrod (Fig. 1) qui, dans le chapitre XV de son livre « The nature and treatment of gout and rheumaticgout « 1,2 a décrit avec précision la maladie telle que nous la connaissons aujourd’hui, en la différenciant de la goutte et du rhumatisme articulaire aigu. Il proposait des illustrations détaillées (Fig. 2) des déformations typiques et soulignait la gravité de la maladie par rapport à d’autres affections, en raison de la difficulté à contrôler la maladie et de son évolution clinique invalidante (Fig. 3).

Photographie de Sir. Alfred Baring Garrod, 1819-1907.3
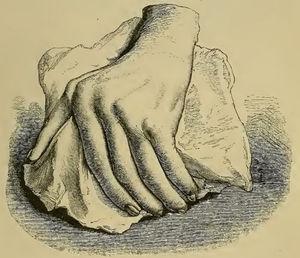
Illustration du livre de Garrod représentant une main déformée avec une déviation cubitale résultant de la polyarthrite rhumatoïde1,2.
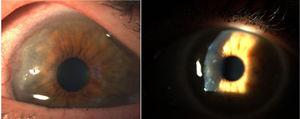
Pannus cornéen.8
Malgré une description clinique très complète de la PR, Garrod a omis de mentionner l’atteinte articulaire du point de vue histopathologique. Des décennies plus tard, William Ord, médecin au St. Thomas’s Hospital de Londres, dans son manuscrit publié dans le British Medical Journal en 1880, a tenté de clarifier certains doutes concernant le terme PR qui, comme il l’a souligné, était fréquemment utilisé de manière non spécifique pour classer différentes maladies. Ord a suggéré que le terme PR ne devait être utilisé que pour le type d’atteinte articulaire inflammatoire avec épanchement différent de la goutte, du rhumatisme articulaire aigu (rhumatisme) ou de la scrofule, qui se caractérise par une atrophie des os et des cartilages, en plus de l’hypertrophie synoviale. Cette déclaration indiquait une relation avec la pathophysiogenèse de la PR.4
En 1905 et 1909, Nichols et Richardson, dans leurs travaux publiés respectivement dans le Journal of Medical Research et dans le Boston Medical and Surgical Journal5, ont présenté l’une des meilleures descriptions clinico-pathologiques des maladies rhumatismales, et ont différencié 2 groupes de patients : l’un présentant les caractéristiques cliniques similaires à la PR et l’autre les caractéristiques de l’ostéoarthrite6. Nonobstant le fait que les deux articles de Nichols et Richardson font référence à des cas d’arthrite déformante non scrofuleuse, la représentation approfondie des manifestations cliniques, accompagnée de photos et d’images radiographiques, décrit clairement des cas de PR. Ces auteurs ont également compilé un certain nombre de spécimens histologiques provenant de 75 cas cliniques et sont parvenus à une conclusion importante : il existe deux types histologiques d’atteinte articulaire, l’un de détérioration du cartilage articulaire, l’autre d’épaississement de la membrane synoviale. Ce dernier est étroitement associé à l’invasion du tissu osseux et du cartilage articulaire, entraînant une destruction et parfois une néoformation osseuse désorganisée. Cette même publication de Nichols et Richardson comprend une description de l’arthrite proliférative avec formation de tissu de granulation très vascularisé, avec une composante cellulaire d’origine mésenchymateuse, principalement de la membrane synoviale et du tissu dit « pannus ». C’est la première fois que le terme pannus articulaire a été utilisé.5 Il faut souligner que le terme pannus avait déjà été utilisé à l’époque en ophtalmologie pour décrire certains types de lésions cornéennes, et était défini par l’Académie américaine d’ophtalmologie comme une croissance de tissu fibreux et vasculaire entre l’épithélium et la membrane de Bowman, souvent présente dans les cas d’œdème cornéen chronique, suite à l’inflammation de la cornée7 (Fig. 7). Dans les deux cas, pannus synovial et pannus cornéen, les lésions décrites s’apparentent à un pannus, mot latin signifiant » tissu « .
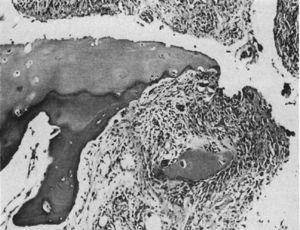
Histologie par microscopie optique. Lésion destructrice au niveau du bord de l’articulation interphalangienne. Le tissu synovial ou pannus peut être apprécié à côté du tissu de granulation – le mouvement dit du crochet isolant un fragment du cartilage marqué « C ».9
Certaines des images et des descriptions de l’étude de Nichols et Richardson en 19095 sont représentées dans les Figs. 4-6.
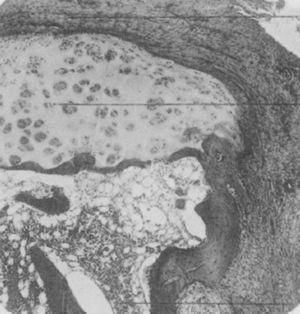
Photo en microscopie optique de la phalange distale d’un patient souffrant de la maladie alors appelée arthrite proliférative de type extrême. Elle montre la formation d’un tissu de granulation épais envahissant et détruisant le cartilage articulaire5,6.
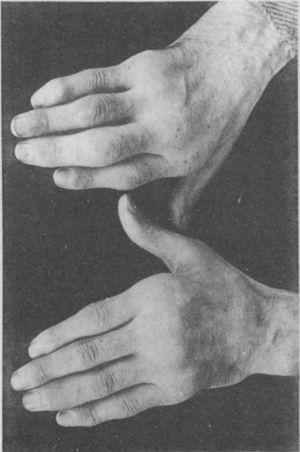
Photographie des mains d’un patient de 35 ans ayant des antécédents d’urétrite gonococcique, qui des années plus tard a progressivement développé une polyarthrite des petites et grandes articulations. Classée comme une arthrite proliférative.5,6
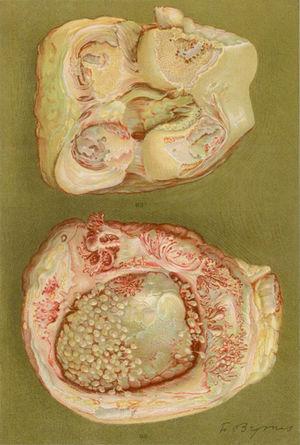
Dessin de la nécropsie d’une femme de 40 ans présentant une clinique de polyarthrite des grandes et petites articulations entraînant un handicap important et des ankyloses. Il existe des preuves de la perte du cartilage articulaire et des zones de formation osseuse donnant lieu à des ankyloses du genou5,6.
En 1959, Kulka a publié une revue de la pathogénie de la PR9, en prenant comme référence le travail de Nichols et Richardson5, qui classait les lésions histologiques de la PR en 3 types : Le premier type était classé comme des modifications inflammatoires de la membrane synoviale, le deuxième comme une dégénérescence et une nécrose du tissu conjonctif, et le troisième comme une infiltration inflammatoire vasculaire des artérioles et des veinules. Le premier type de lésions correspond au pannus décrit en 1909 par Nichols et Richardson, consistant en un épaississement synovial qui entraîne une résorption du cartilage. Kulka a constaté en utilisant la microscopie optique que, d’une part, la lésion destructrice du cartilage était caractérisée par la croissance de tissu synovial chroniquement enflammé – ou pannus – et que, d’autre part, le tissu de granulation qui a proliféré à partir des espaces de moelle osseuse sous-chondraux et s’est étendu à travers la plaque sous-chondrale pour se fixer au pannus et l’entourer d’un mouvement de pince, peut progresser pour isoler des fragments du cartilage marginal (figure 7).9
Kulka dans son article a défini les critères histologiques permettant de diagnostiquer la PR, si au moins 3 des 5 caractéristiques distinctives étaient réunies, en l’absence de tout autre diagnostic probable :
-
Prolifération veineuse
-
Prolifération des cellules synoviales superficielles, généralement palissadique
-
Infiltration marquée de cellules inflammatoires (lymphocytes ou plasmocytes) avec une tendance à développer des nodules lymphoïdes
-
Dépôt de fibrine compact
Bien que l’on ait insisté sur le fait qu’aucune de ces caractéristiques n’était spécifique, la combinaison de 3 caractéristiques ou plus en l’absence d’autres pathologies avait une valeur diagnostique considérable pour la PR (Fig. 8).

Histologie par microscopie optique. Synovite classique du genou dans la PR décrivant une hypertrophie villositaire, une infiltration vasculaire et des nodules lymphoïdes avec un centre germinal dans le coin droit9.
Microscopie électronique et modèle tumoral de pannus
En 1975, Kobayachi et Ziff10 ont mené des études en microscopie électronique sur le pannus et son attachement au cartilage, afin de contribuer à la compréhension des dommages articulaires. Bien qu’en 196011 Ziff ait déjà décrit des altérations de la membrane synoviale, les deux auteurs ont décrit que des protéases lysosomales pouvaient se développer à l’intérieur du pannus, qui dégradent les mucoprotéines du cartilage et peuvent être sécrétées dans des sites spécifiques, comme les marges articulaires où a lieu la production initiale de pannus ; autrement dit, à l’interface de la membrane synoviale et du cartilage articulaire12.
Ces chercheurs ont analysé des échantillons de l’interface synovie-cartilage chez 8 patients avec un diagnostic de PR, et ont identifié 3 types de lésions : la première avec une infiltration de cellules mononucléaires des vaisseaux empiétant sur le cartilage, formant parfois des nids ou des agrégats cellulaires à l’intérieur de la matrice cartilagineuse (en plus des plasmocytes, lymphocytes et granulocytes). De plus, du collagène circulant dissous a également été retrouvé à l’intérieur de ces nids, ce qui a conduit à la théorie d’une sécrétion d’enzyme protéolytique (Fig. 9). Le deuxième type de lésions correspond à une invasion directe du cartilage par des cellules monocytaires et des fibroblastes peu différenciés qui peuvent se manifester comme phagocytaires ou fibroblastiques, avec un contenu granulaire cytoplasmique amorphe avec des prolongements cellulaires qui dégradent la matrice collagène cartilagineuse et peuvent être vus à l’intérieur des extensions cellulaires (Fig. 10). Le troisième type de lésion se présente comme une épaisse couche de tissu fibreux et vascularisé recouvrant le cartilage et interférant avec la vascularisation normale du cartilage articulaire.

Image au microscope électronique montrant des fibroblastes avec des lysosomes immergés (Lys) et de multiples extensions cytoplasmiques envahissant la matrice du cartilage (Ctm).10
Au cours des deux décennies suivantes, le rôle prépondérant du pannus dans la physiopathologie de la maladie articulaire dans la PR ne s’est pas limité à la description de la destruction du cartilage. Edward Harris a publié en 199013 l’une des études les plus complètes sur la physiopathologie de la PR, qu’il a classée en 5 types, en fonction des caractéristiques immunologiques des lésions articulaires. Il a décrit que dans les stades initiaux (stade 2), la synovie non épaissie et la néovascularisation médiée par les cytokines des macrophages14 avec accumulation des lymphocytes périvasculaires jouent un rôle15. Comme l’a précédemment démontré Kobayashi10 en utilisant la microscopie électronique, les lymphocytes – principalement T CD4+16 avec de rares régulateurs T17 – activent les lymphocytes B locaux qui se transforment en plasmocytes producteurs d’anticorps dans le tissu synovial18, compromettant ce tissu dans le cadre de l’apparition et de la progression de la maladie. Harris a également affirmé qu’à des stades plus avancés de la maladie (stade 4), une prolifération profuse de la synovie avec jusqu’à 100 fois son poids normal, ce qui a été interprété comme un comportement similaire à celui d’une tumeur avec une activité cellulaire accrue des synoviocytes, comme cela a été confirmé dans un milieu de culture enrichi où les cellules se sont développées de manière isolée et autonome19, ce qui a conduit à envisager pour la première fois le modèle des oncogènes, comme c’est le cas dans le cancer.
Composants cellulaires du pannus
Bien que plusieurs chercheurs aient continué à étudier le tissu épaissi ou composant du pannus, aucun accord n’a été atteint en ce qui concerne sa pathogenèse. En 1983, Burmester et al.20 ont étudié les cellules non-lymphocytaires du pannus via des anticorps monoclonaux ciblés contre les antigènes des macrophages et des fibroblastes. Ils ont identifié 3 types de cellules de la lignée synoviale ; le premier était principalement (40% du total) des cellules monocytaires ou des macrophages avec une capacité phagocytaire, avec des récepteurs Fc et une expression HLA DR ou type II. Le deuxième type de cellules était similaire aux monocytes, mais non phagocytaire, avec une expression HLA-DR et aucun autre antigène monocytaire trouvé. La dernière lignée cellulaire trouvée était positive pour les marqueurs de fibroblastes, mais sans expression de HLA-DR ou d’autres antigènes monocytaires (entre 20 et 40 % du total), ce qui a été confirmé en 1987 avec des cellules clonées et des cultures cellulaires21. La signification de ces cellules synoviales était, entre autres, l’activation du proto-oncogène c-jun en réponse au stimulus de l’IL-a,22 qui est similaire aux cellules néoplasiques qui augmentent l’expression de la collagénase avec la capacité de détruire, avec la stromelysine et d’autres métalloprotéinases, le cartilage et la matrice osseuse,23,24 une découverte précédemment attribuée à Ziff en 1960.11
Zvaifler et Firestein25 en 1994 considéraient que l’origine du pannus n’était pas claire et que les éléments de preuve se divisaient en un tissu synovial chroniquement enflammé et un tissu conjonctif spécialisé et hautement vascularisé qui commençait à l’interphase synovie-os et qui avait historiquement été défini comme le site de début du processus destructeur5,10,26,28. Deux possibilités concernant l’origine de ces synoviocytes ont été envisagées dans cette revue, qui sont similaires aux fibroblastes et ont reçu le nom de pannocytes.20 La première hypothèse est que les cellules mésenchymateuses immatures ont été les premières à envahir les vaisseaux qui pénètrent le cartilage et qui pourraient être remplacés ou évoluer vers des fibroblastes,27 dans un processus médié par des facteurs inflammatoires inconnus (facteur X), indépendants des facteurs immunitaires dérivés des cellules T, comme cela a également été montré dans des modèles animaux.29,30 La deuxième hypothèse moins soutenue, et basée sur des études menées au début des années 90,31-33 dépendait des cytokines des lymphocytes et décrivait l’expression génomique réduite des lymphocytes et des produits lymphocytaires dans les tissus et dans le liquide synovial (Fig. 11).

Autres voies par lesquelles le facteur inconnu « X » de la PR pourrait induire la formation du pannus. Il peut commencer par la voie dépendante des cellules T ou par la voie des synoviocytes25.
La revue de Zvaifler et Firestein25 tente de comprendre, non seulement l’origine, mais la perpétuation du pannus, en se basant sur 2 possibilités : l’une – évoquée dès 1989 – envisage un modèle tumoral dans lequel les cellules synoviales sont transformées par un signal déclenchant la prolifération et induisant l’expression d’oncogènes et la production d’enzymes dégradant la matrice ou les protéines d’adhésion.34,35 Ces signaux peuvent provenir de molécules solubles comme les cytokines ou d’agents étiologiques non spécifiés. Dans cette perspective, les tissus tels que le cartilage ou l’os, ne participent pas à leur développement, mais sont affectés par le pannus. La deuxième possibilité repose sur l’idée que les composés générés par les chondrocytes ou les complexes immunitaires immergés dans le cartilage sont ceux qui sont responsables de l’activation des synoviocytes pour qu’ils envahissent le tissu et abandonnent leur environnement naturel.
Toutefois, le processus par lequel les synoviocytes de type fibroblaste, dépourvus de récepteurs Fc, sont affectés par ces complexes immunitaires36 n’a pas été établi, mais il est probable que les cellules monocytiques-macrophages en soient les intermédiaires. Une explication probable de cet événement est la liaison des protéines du complément et des complexes immuns à la vitronectine et à ses récepteurs, qui affecte la différenciation, la migration et la prolifération des fibroblastes et qui est ensuite amplifiée par le contact de ces cellules avec le collagène, la fibronectine et d’autres métalloprotéinases37,38, via l’expression de récepteurs tels que le VCAM-1, qui était jusqu’alors la seule molécule d’adhésion connue surexprimée dans les synoviocytes de type fibroblastique39.
Selon ce deuxième scénario, le cartilage ne sera pas seulement le tissu affecté par le pannus, mais l’inducteur et le perpétuateur de cette réponse. En dépit de ce qui précède, il reste clair que la conservation du pannus dépend des cytokines qui stimulent la croissance cellulaire et de la production d’enzymes synthétisées par les synoviocytes dérivés de monocytes40 et par les synoviocytes de type fibroblaste. Il a été démontré in vitro que les enzymes étaient synthétisées41 via la régulation et l’intermédiation des lymphocytes T, des monocytes et de leurs sous-produits qui représentent la plupart des cellules du pannus.42
Le travail de Burmester en 198320 a été fondamental pour la continuité de l’étude de la composante cellulaire du pannus. En 1997, le groupe de Xue a étudié des spécimens d’arthroplastie contenant du pannus de patients atteints de PR et a observé des cellules PSC dont le phénotype a été étudié par microscopie et immunohistochimie, avec une protéine spécifique et une expression génomique.43 Ces cellules se sont révélées positives pour les filaments de vimentine, marqueurs d’immunofluorescence (Fig. 12) et étaient morphologiquement similaires aux fibroblastes sous le microscope. Cependant, le marqueur safranine O qui réagit avec les protéoglycanes (Fig. 13), ainsi que l’expression de l’ARNm du collagène de type II qui est utilisé pour identifier les cellules de type chondrocyte, étaient également positifs ; d’où la conclusion que ces cellules sont une combinaison de fibroblastes et de chondrocytes.
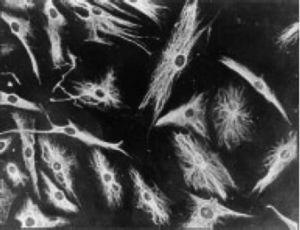
Micrographie en immunofluorescence montrant la positivité des cellules PSC aux anticorps anti-vimentine marqués à l’isothiocyanate de fluorescéine. Ce résultat est similaire à celui observé dans les fibroblastes43.
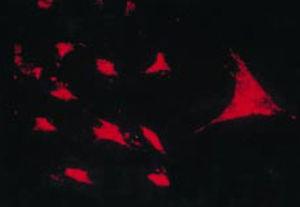
Test de transcriptase inverse in situ pour montrer l’expression de l’ARN du collagène de type II dans une culture de CSP, qui véhicule des caractéristiques de type chondrocyte43.
L’étude de l’expression du génome a également mis en évidence la forte activité des proto-oncogènes pour c-myc, c-jun et c-fos qui permet la production élevée d’enzymes telles que la cathepsine B et L et certaines collagénases.
Dans les années qui ont suivi, d’autres éléments ont été divulgués sur les caractéristiques du tissu dans les maladies articulaires précoces et l’expression accrue du gène p53,44 des mutations qui étaient plus souvent observées dans les stades avancés45. En 2003, Smeets et al. ont observé des différences dans les caractéristiques cellulaires, l’expression des cytokines, les facteurs angiogéniques et les métalloprotéinases du pannus, obtenu à partir de spécimens de patients atteints d’une maladie tardive qui avaient subi une arthroplastie sans aucun signe d’activité clinique de l’arthrite, par rapport à des patients ayant subi une arthroscopie et considérés comme étant dans les premiers stades de la maladie parce qu’ils avaient encore une activité clinique de l’arthrite46 . Les différences entre les deux groupes étaient le plus grand nombre de macrophages et de lymphocytes T dérivés des spécimens d’arthroscopie ou de la maladie précoce, et l’expression plus élevée du TNF-a, de l’IL-6, des métalloprotéinases (MMP-1, MMP-3, MMP-13) et du facteur d’angiogenèse (VEGF).
Le pannus est souvent considéré comme un tissu fibreux sans activité biologique majeure et un vestige de la lésion articulaire qui semble irréversible. Cependant, le pannus se comporte comme un milieu produisant de grandes quantités d’enzymes protéolytiques, avec un rôle pathologique central, comme les MMP 1, 3, 13 et 14.47 La MMP 3 ou stromelyn (mentionnée ci-dessus)23,24,48 en particulier, est produite de manière intensive comme cela a été montré en 200549 par la détection de l’ARNm à la jonction synovie-cartilage, et dépend de l’IL-1b pour la stimulation de la synthèse. La MMP 3 diffère de la MMP 1 ou collagénase de type 1, car elle est moins abondante et est stimulée par le TNF-a.
Pannus et facteur nucléaire kappa B
Le facteur de transcription nucléaire kappa B (NF-kB) est l’un des plus importants régulateurs de la transcription génomique des cytokines, des chimiokines et des molécules d’adhésion ; il joue un rôle dans la dégradation du cartilage et de l’os articulaire,50 est augmenté à la fois dans le tissu synovial des patients et des modèles animaux atteints de PR,51-53 principalement à la jonction pannus-cartilage53 où l’on trouve un plus grand nombre de cellules productrices du facteur, par rapport à d’autres sites synoviaux en dehors de cette jonction. L’importance du facteur NFkB en termes de lésions articulaires ne se traduit pas seulement par l’augmentation du nombre de cytokines, mais aussi par l’ostéoclastogenèse – un processus clé de l’érosion osseuse54,55 qui dépend de la lignée myéloïde et du complexe RANK-RANKL56-58, permettant l’activation, la migration et la survie de l’ostéoclaste59,60. Le RANKL provient des lymphocytes T, des synoviocytes de type fibroblastique et des cellules situées en dehors de l’interface pannus-os.50,61-63 Pettit et al, en 2006,64 ont étudié le profil d’expression du RANKL, du NF-kB et de l’ostéoprotégérine (inhibiteur naturel du RANKL qui bloque sa liaison au récepteur et empêche donc l’ostéogenèse) dans des échantillons de pannus de patients atteints de PR, en particulier au niveau de l’interface pannus-os où il n’avait jamais été étudié. Le résultat a été que tant le RANKL que l’ostéoprotégérine sont exprimés dans les micro-environnements où le pannus s’interface avec l’os ou le cartilage et où il y a érosion ou lésion tissulaire, toujours dans des proportions qui favorisent la maturation de l’ostéoclaste et son activation. Ce déséquilibre moléculaire a été ratifié en 2008.65
Images diagnostiques et pannus
En 1978, Cooperberg a été le premier à montrer la synovite avec des ultrasons, en observant un épaississement de la membrane synoviale du genou sur une image en niveaux de gris66. D’autres détails ont été observés dans le travail de De Flaviis en 1988, mettant en œuvre un protocole d’échographie dans la main de patients atteints de PR.67 Six années se sont écoulées jusqu’à ce que Newman utilise la méthode Doppler sur les tendons et les bourses68, et deux ans plus tard, il l’a utilisée pour l’épaississement de la synovie dans les genoux de patients atteints de PR69. Natias Hau en 1999, avec des ultrasons à haute résolution, a utilisé pour la première fois le mode Doppler sur le pannus des mains de patients atteints de PR, montrant une hypervascularisation70 des articulations du genou, confirmant ainsi la vascularisation accrue déjà décrite dans des études menées un siècle auparavant (Fig. 14).5,12,14,15
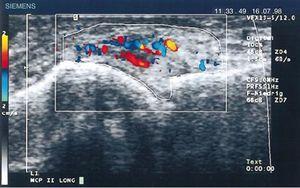
Échographie longitudinale de l’articulation métacarpophalangienne montrant les premières images Doppler avec une vascularisation accrue du pannus chez un patient atteint de PR70.
Ayant mis en évidence des changements dans le tissu synovial à l’aide d’ultrasons, l’étape suivante consistait à établir si ce pannus, tel qu’il est observé cliniquement, présente également une involution. Le premier à réaliser ce type d’étude échographique a été Newman en 1996, lorsqu’il a utilisé le Doppler dans la PR69 en remarquant des changements dans la quantité de vascularisation après une corticothérapie intra-articulaire. Ces mêmes résultats ont été observés dans les travaux de Stone en 2001.71 Il a comparé les images d’articulations métacarpophalangiennes, avant et après un traitement par méthylprednisolone intraveineux ou prednisolone oral. En utilisant des inhibiteurs du TNF-a, Hau et al. ont publié un article en 2002, montrant les changements dans la vascularisation du pannus72 chez les patients traités à l’étanercept, et également dans des études ultérieures73.-76 Taylor a montré le changement d’hypervascularisation avec l’infliximab77 et Naredo a fait de même en 2008.78
L’utilisation de la résonance magnétique qui a débuté en 1988 avec les travaux de Gilkenson a montré que c’était une meilleure méthode pour détecter les érosions de la main chez les patients atteints de PR79 ; Kusunoglu en 1990 a montré qu’elle était utile pour différencier l’épaississement synovial de l’épanchement articulaire80. La visualisation du pannus par cette méthode a commencé en 1994, lorsque pour la première fois Ostergaard a évalué la croissance synoviale et sa relation avec l’activité de la maladie81, confirmée par un travail plus approfondi de Sugimoto en 199882, et enfin en 2003 le groupe OMERACT a défini la synovite en résonance magnétique nucléaire comme une augmentation de l’épaisseur synoviale après injection de contraste ; c’est définitivement la preuve du pannus83.
Conclusions
L’histoire a permis de comprendre le rôle essentiel du pannus dans la destruction articulaire, qui s’apparente parfois à une lésion tumorale du fait de sa croissance rapide et abondante, favorisant la production d’anticorps qui perpétuent le processus auto-immun. Ceci contredit l’idée que le pannus est un tissu de granulation peu actif, limité à un simple tissu cicatriciel résiduel. Ces caractéristiques interfèrent avec les processus de développement, de progression et de destruction de l’os et du cartilage de l’articulation qui ont été mis en évidence depuis plus de 100 ans, et prouvés par des techniques de microscopie et de biologie moléculaire. Par conséquent, l’idée que le pannus est une condition définitive ou irréversible est incorrecte, puisqu’il ne s’agit pas d’une partie active de la maladie, et qu’au contraire, il peut être inversé en réponse au traitement. L’utilisation incorrecte du terme doit être évitée pour rendre l’évaluation clinique de la maladie moins confuse. Ces changements ont été historiquement attribués à la synovite, qui est simplement l’inflammation du tissu synovial évaluée cliniquement. Le terme de synovite ne peut pas être différencié de celui de pannus, car il fait référence à une découverte histologique et, par conséquent, le pannus n’est pas compris dans l’évaluation clinique initiale ou dans le suivi des patients atteints de PR par les différentes sociétés scientifiques.
Des études supplémentaires sur le pannus en tant que composante indispensable de la pathogenèse de la PR contribueront à une meilleure compréhension de la maladie dès son apparition, et ouvriront de nouvelles voies pour son évaluation clinique ou par imagerie, en plus de l’identification de thérapies plus ciblées qui inhibent la destruction des articulations.
Conflit d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à divulguer.