Em 1889, Svante Arrhenius propôs a equação de Arrhenius a partir das suas observações directas dos lotes de constantes de taxa vs. temperaturas:
\
A energia de activação, Ea, é a energia mínima que as moléculas de energia devem possuir para reagir para formar um produto. A inclinação da parcela de Arrhenius pode ser utilizada para encontrar a energia de activação. A parcela de Arrhenius também pode ser utilizada extrapolando a linha de volta para o intercepção y para obter o factor pré-exponencial, A. Este factor é significativo porque A=p×Z, onde p é um factor estéreo e Z é a frequência de colisão. O factor pré-exponencial, ou frequência, está relacionado com a quantidade de vezes que as moléculas vão bater na orientação necessária para causar uma reacção. É importante notar que a equação de Arrhenius se baseia na teoria da colisão. Ela afirma que as partículas devem colidir com a orientação adequada e com energia suficiente. Agora que obtivemos a energia de activação e o factor pré-exponencial do gráfico de Arrhenius, podemos resolver para a constante de taxa a qualquer temperatura usando a equação de Arrhenius.
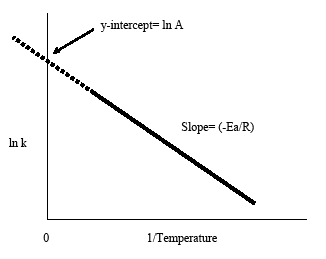
O gráfico de Arrhenius é obtido traçando o logaritmo da constante de taxa, k, versus a temperatura inversa, 1/T. A linha negativa resultante é útil para encontrar os componentes em falta da equação de Arrhenius. A extrapolação da linha de volta para o intercepção y produz o valor para ln A. A inclinação da linha é igual à energia de activação negativa dividida pela constante de gás, R. Como regra geral na maioria das reacções biológicas e químicas, a taxa de reacção duplica quando a temperatura aumenta a cada 10 graus Celsius.
p>Locando a equação de Arrhenius, o denominador da função exponencial contém a constante gasosa, R, e a temperatura, T. Este é apenas o caso quando se trata de toupeiras de uma substância, porque R tem as unidades de J/molK. Quando se lida com moléculas de uma substância, a constante de gás no dominador da função exponencial da equação de Arrhenius é substituída pela constante de Boltzmann, kB. A constante de Boltzmann tem as unidades J/K. À temperatura ambiente, kBT, é a energia disponível para uma molécula a 25 C ou 273K, e é igual a aproximadamente 200 números de onda.
É importante notar que a decisão de utilizar a constante de gás ou a constante de Boltzmann na equação de Arrhenius depende principalmente do cancelamento das unidades. Para tomar o registo inverso de um número, o número deve ser sem unidades. Por conseguinte, todas as unidades no factor exponencial devem ser canceladas. Se a energia de activação for em termos de joules por moles, então a constante de gás deve ser utilizada no dominador. No entanto, se a energia de activação estiver em unidades de joules por molécula, então a constante, K, deve ser utilizada.
- Equação de Arrhenius por molécula \
- Equação de Arrhenius por molécula \
Equação de Arrhenius “Linearizada”
A equação de Arrhenius (Equação \ref{eq1}) pode ser reordenada para lidar com situações específicas. Por exemplo, tomando o logaritmo de ambos os lados, obtém-se a equação acima na forma y=-mx+b.
Então, um gráfico de {\ k^1} vs. {\ k^1/T} e todas as variáveis podem ser encontradas.
- \(y=ln k\)
- \(m=-Ea/RT\)
- \(x=1/T\)
- \(b=ln A\)
Esta forma da equação de Arrhenius facilita a determinação da inclinação e do conceito y a partir de um gráfico de Arrhenius. É também conveniente notar que a equação acima mostra a ligação entre a temperatura e a constante de taxa. À medida que a temperatura aumenta, a constante de taxa decresce de acordo com a parcela. A partir desta ligação podemos inferir que a constante de taxa é inversamente proporcional à temperatura.
Forma integrada
A forma integrada da equação de Arrhenius também é útil (Equação \ref{eq3}). Esta variação da equação de Arrhenius envolve a utilização de duas parcelas de Arrhenius construídas no mesmo gráfico para determinar a energia de activação. A equação acima, mostra o efeito da temperatura sobre as constantes de taxas múltiplas. Isto permite inferir facilmente a sensibilidade das constantes de taxa à energia de activação e às mudanças de temperatura. Se a energia de activação for elevada para uma determinada gama de temperaturas, então a constante de taxa é altamente sensível; as mudanças de temperatura têm um efeito significativo sobre a constante de taxa. Se a energia de activação for baixa para um determinado intervalo de temperatura, então a constante de taxa é menos sensível, e as mudanças de temperatura têm pouco efeito sobre a constante de taxa. Este fenómeno é ilustrado graficamente no exemplo abaixo:
| 1/Temp | 0.0085 | |||||
|---|---|---|---|---|---|---|
| 3 | 2.5 | 1.5 | 1 | |||
| lnk (pequena Ea) | 1.8 | 1.7 | 1.6 | 1.5 | 1.4 | 1.3 |
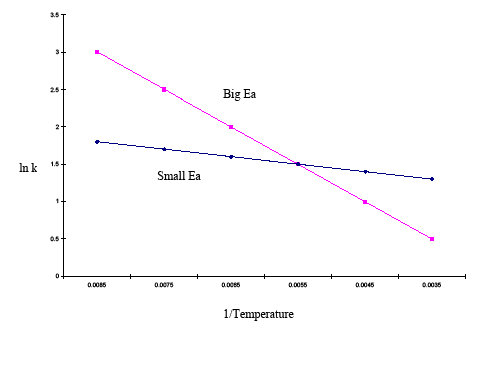
O gráfico acima mostra que a parcela com a inclinação mais acentuada tem uma maior energia de activação e a parcela com a inclinação mais plana tem uma menor energia de activação. Isto significa que na mesma gama de temperaturas, uma reacção com uma energia de activação mais alta muda mais rapidamente do que uma reacção com uma energia de activação mais baixa.
Significância Biológica
O gráfico Arrhenius pode tornar-se não linear se os degraus se tornarem limitadores de taxa a diferentes temperaturas. Tal exemplo pode ser encontrado com a Fox e colegas de trabalho em 1972 com o transporte beta-glicosídeo em E. coli. As diferenças nas temperaturas de transição são devidas à composição de ácidos gordos nas membranas celulares. A diferença de estado de transição é o resultado da mudança brusca de fluidez da membrana. Outro exemplo inclui uma queda repentina a baixas 1/T (temperaturas elevadas), resultado da desnaturação da proteína.
Key Points
- Arrhenius plots mostram que as taxas de reacção são inversamente proporcionais às mudanças de temperatura
- A inclinação negativa do plot Arrhenius dá a energia de activação, Ea: declive = -Ea/R
- Extrapolação do gráfico de Arrhenius de volta ao conceito y dá lnA
- O gráfico de Arrhenius mostra como a energia de activação e a temperatura afectam a sensibilidade da taxa de reacção
Problemas de prática
1. T/F O Ea calculado a partir da equação de Arrhenius dá um valor exacto.
2. Descrever a relação entre temperatura e Ea e dar exemplos.
3. Usando a seguinte informação:
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8,314 J mol/K
Calcular k a 27° C com unidades adequadas.
4. Usando informação do problema 3, calcular k a 37° C com unidades adequadas.
5. Usando a equação integrada resolver para Ea usando:
k1=7,78×10-7 a T1=273 K
k2=3,46×10-5 a T2=298 K
Respostas
- Falso: Ea é um valor médio ou “aparente”.
- À medida que a temperatura aumenta, a constante de taxa diminui quando a equação acima é traçada. O mesmo é verdade quando a temperatura diminui, a constante de taxa aumenta. A partir desta ligação, a constante de taxa é inversamente proporcional à temperatura.
- k= 8.727 sec-1
- k=23.02 sec-1
- li>Ea=1.026×105 J/mol
Contribuidores e Atribuições
- David Johns e Andra Hutton (UC Davis)