Facts, Summary & Definition
- Allosteric Enzymes são enzimas que têm um local adicional para um efeito ou aglutinação, assim como o site activo
- Eles são reguladas através de regulação homotrópica ou heterotrópica
li>Efforts regulam a actividade da enzima – podem activar ou inibirli>As enzimas alostáreas são maiores e mais complexas do que as enzimas normais
O que são enzimas alostáreas?
Vocês lembrar-se-ão que as enzimas são classificadas como catalisadores biológicos. Ou seja, ajudam a acelerar a taxa de reacção, mas permanecem inalteradas durante todo o processo.
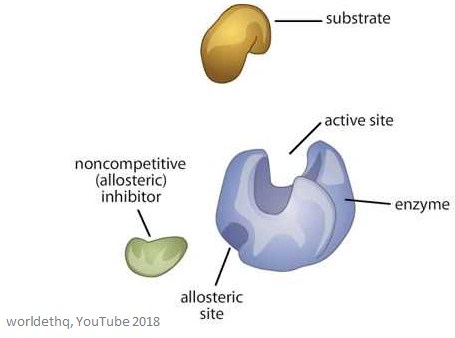
As enzimas alostéricas são enzimas que têm um sítio adicional, bem como o sítio activo – vem do grego ‘allo’, que significa ‘outro’. Estes são chamados sítios alostéricos, e as enzimas podem ter mais do que um. São únicos na medida em que têm a capacidade de responder a múltiplas condições diferentes no seu ambiente imediato. Além disso, quando as enzimas alérgicas são mostradas num gráfico como velocidade contra a concentração do substrato, elas mostram uma curva sigmóide em vez da habitual curva hiperparabólica.
A imagem abaixo mostra uma enzima alérgica genérica.

Propriedades de enzimas alostóreas
Os sítios alostóricos são sítios de ligação da enzima – são diferentes do sítio activo e do sítio de ligação do substrato.
A molécula que se liga ao sítio alostérico é chamada de efector (também pode ser chamada de modulador), e regula a actividade da enzima a que se liga.
A actividade da enzima é aumentada quando um efector alostérico positivo se liga ao sítio alostérico. Isto significa que a actividade da enzima é diminuída quando um efetor alérgico negativo se liga ao sítio alérgico – inibem a enzima.
As enzimas alérgicas são maiores e mais complexas do que as enzimas não alérgicas e muitas vezes têm muitas sub-unidades. Enzimas com mais do que um effector têm sítios de ligação diferentes e específicos para cada um deles. Na maioria das enzimas alostóricas, o local de ligação do substrato e o local de ligação do efetor encontram-se em subunidades diferentes.
O local de ligação do substrato encontra-se na subunidade catalítica – frequentemente referida como subunidade C. O local de ligação do efector encontra-se na subunidade reguladora – frequentemente referida como subunidade R.
Quando uma molécula efetora num local de ligação provoca uma alteração conformacional na subunidade, uma alteração conformacional é então causada nas outras subunidades da proteína – isto significa que uma grande parte da energia de ligação do efector é utilizada para alterar a conformação de todo o complexo proteico.
Esta interacção entre todas as subunidades pode ser expressa usando o coeficiente de Hill – a isto também se chama coeficiente de cooperatividade. Quando n=1, não haverá interacção entre as subunidades da enzima. Quanto maior for o coeficiente de Hill (coeficiente de cooperatividade), mais fortes serão as interacções entre todas as subunidades da enzima.
As enzimas alostáticas podem também ‘alternar’ entre a sua forma activa e a sua forma inactiva. Isto permite padrões sofisticados de resposta em actividade, que podem desempenhar um papel enorme na função biológica. Uma vez que o efetor se dissocia do local de ligação, a enzima é então capaz de voltar à sua forma inativa (ou menos ativa). Podem controlar as taxas de reacções altamente importantes, tais como a produção de ATP.
Quando um efetor se liga a uma enzima, é chamado de ligação cooperativa.
Regulação homotrópica
Um efetor homotrópico aloésico é um substrato para a enzima, bem como uma molécula reguladora – o prefixo ‘homo’ refere-se a eles serem o mesmo. São geralmente activadores da enzima. A imagem abaixo mostra um efector aloétrico homotrópico.

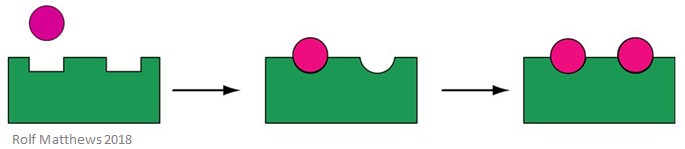
Um bom exemplo de um efector aloestésico homotrópico é o oxigénio (O2) – actua como um efector da hemoglobina no corpo humano.
Regulação heterotrópica
Um efector aloétrico heterotrópico é uma molécula reguladora que não é também o substrato para a enzima. Pode activar ou inibir a enzima a que se liga. A imagem abaixo mostra um efeito alostárico heterotrópico.

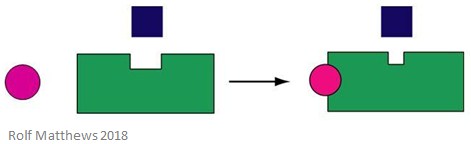
Um bom exemplo de um efetor heterotrópico aloestésico é o dióxido de carbono (CO2) – também actua como um efetor da hemoglobina mas não é o substrato da enzima.
Activadores Essenciais
Activadores Essenciais são activadores alostéricos que, sem os quais, a actividade enzimática seria tão baixa que seria insignificante. Por exemplo, o N-acetilglutamato é um activador essencial para a carbamoyl fosfato sintetase I. São exactamente o oposto dos inibidores enzimáticos.