Abstract
Fundo
O diagnóstico de enfarte agudo do miocárdio (IAM) é actualmente confirmado pela determinação da troponina plasmática I (pTi). Com base nos relatórios anteriores, que as plaquetas de indivíduos com IAM agregadas por diferentes agentes agregadores não podiam ser inibidas pelo ácido acetil salicílico (aspirina), foi estudada a viabilidade do diagnóstico de IAM.
Métodos
Subjectos entre 40-60 anos com IAM (n=50, M=35, F=15) ou ACS (n=30, M=20, F=10) e um número igual de voluntários normais de idade e sexo compatível participaram no estudo. A inibição de 80 µM de aspirina de agregação plaquetária induzida por 2,0 µM de ADP foi estudada incubando o plasma rico em plaquetas (PRP) com o composto durante 30 min a 37°C e a agregação foi realizada num agregador óptico.
h4>Resultadosp>p>Apesar do PRP normal, a inibição induzida pela aspirina foi ≈100%. No caso de ACS, a percentagem de inibição foi de 63,2% em comparação com os casos de AMI onde não houve inibição (i.e. 0% inibição, p<0,001) pela aspirina na agregação plaquetária induzida por ADP (sensibilidade= 92% e especificidade = 100%).
Conclusão
Era possível diagnosticar a ocorrência de IAM pela ausência do efeito inibidor da aspirina na agregação plaquetária.
Palavras-chave
agregação plaquetária, diagnóstico de enfarte do miocárdio, troponina, aspirina.
Introdução
A agregação de plaquetas por diferentes agentes agregadores plaquetários incluindo ADP, l-epinefrina, colagénio ou trombina é conhecida por ser essencial para o processo de salva-vidas da coagulação do sangue. Por outro lado, a agregação excessiva de plaquetas no local da ruptura da placa aterosclerótica na parede da artéria coronária é relatada como resultando no desenvolvimento de trombo, um microagregado de plaquetas, que por vezes pode levar ao bloqueio da circulação sanguínea normal na musculatura do coração, e que em consequência pode resultar na síndrome coronária aguda (SCA) . Embora a agregação de plaquetas no local de ruptura da placa arterial possa desenvolver-se em SCA, a agregação de plaquetas, por vezes também pode bloquear a artéria pericárdica, o que pode resultar na morte das células cardíacas, que apareceram como áreas escuras e fragmentadas de enfartes desenvolvidos devido à morte de células cardíacas que, em última análise, podem levar a um enfarte agudo do miocárdio (IAM), que, quando maciço, pode resultar na morte das vítimas. Os enfartes transmurais dependem da extensão dos danos no miocárdio que podem ou não ser sempre expressos como onda Q anormal, mas também podem estar envolvidos no aparecimento de ondas ST e T anormais em 50% dos casos no ECG, resultando em enfarte do miocárdio com elevação de St-Elevated Myocardial Infarction (STEMI) ou não-STEMI, e como tal, o ECG pode não ser diagnosticamente útil para determinar a ocorrência de IAM. Embora a dor torácica seja geralmente grave e dure mais do que no caso da SCA, sabe-se que a dor em si é de natureza subjectiva e pode ser um evento simulado que não seja pelo próprio IAM. E, como tal, o diagnóstico de IAM é geralmente confirmado pela determinação da troponina I plasmática (pTi) pelo Enzyme Linked Immuno Sorbent Assay (ELISA) usando o anticorpo troponina I.
No entanto, tanto a troponina I (Ti) como o seu anticorpo são caros e, além disso, o próprio ELISA pode nem sempre ser suficientemente rápido para confirmar a ocorrência de IAM em situação exigente, que pode ser necessária para a possível intervenção terapêutica para a doença. Por estas razões, o diagnóstico laboratorial de IAM não está disponível, não necessariamente por escolha, em muitas partes do mundo.
Nós relatamos recentemente que o Plasma Rico em Plaquetas (PRP) de doentes com IAM pré-incubado com 80 µM de ácido acetil salicílico (aspirina), durante 30 min a 37°C não conseguiu inibir a agregação de plaquetas iniciada por diferentes agentes agregadores de plaquetas incluindo o ADP quando comparado com o PRP normal ou com o PRP da ACS. Com base nestes estudos preliminares, estudámos a possibilidade de confirmar a ocorrência de AMI por agregação óptica mesmo na ausência da determinação do pTi.
Nós relatamos aqui a viabilidade de confirmar a ocorrência de AMI diferenciado da ocorrência de ACS através da determinação da inibição induzida pela aspirina da agregação plaquetária induzida pelo ADP utilizando um agregador. A ocorrência de AMI foi confirmada por determinação paralela e simultânea do pTi por ELISA.
Métodos e materiais
Desobstrução ética
O projecto de investigação, ”Diagnóstico laboratorial de enfarte agudo do miocárdio por agregometria óptica de plaquetas” requereu uma quantidade nominal de sangue (2 mL) dos doentes com IAM ou SCA e dos voluntários normais. O Conselho de Revisão Institucional, Human & Animal Research Ethics Committee, Sinha Institute of Medical Science And Technology, Kolkata, Índia aprovou o estudo na condição que se seguiu ao Protocolo de Ética Humana aprovado estritamente de acordo com a declaração de Helsínquia de 1964 e nenhum desvio no estudo foi permitido sem a autorização prévia por escrito do conselho. Todos os participantes tinham entre 40-60 anos de idade. Nenhuma atrasada mental, mulher grávida ou prisioneira participou no estudo. Todos os voluntários assinaram um termo de consentimento informado antes da sua participação no estudo. Nos casos de sujeitos ACS ou AMI, a autorização para participar no estudo também foi obtida dos familiares do paciente, mediante a assinatura de uma declaração judicial. Os médicos assistentes decidiram se a amostra de sangue (2 ml) poderia ser retirada do paciente sem colocar o sujeito em qualquer perigo. O sangue foi retirado pelo médico assistente ou por uma enfermeira licenciada. Foi assegurado que os voluntários não tinham outra infecção que ameaçasse a vida. A comissão inspeccionou rotineiramente o progresso e os problemas da investigação em curso.
Químicos
A imunoglobulina de cabra anti-coelho G-fosfatase alcalina e ADP foram obtidas da Sigma Aldrich. O Enzyme Linked Immunosorbent Assay (ELISA) maxisorp placas foram de Nunc, Rosaklide, Dinamarca. Troponina I, anticorpo Troponina I, CK-MB, anticorpo CK-MB foram obtidos de Abcam. Acetyl Salicylic Acid (aspirina) foi obtido da Medica Zydus Healthcare. Todos os outros químicos utilizados foram de grau analítico.
Selecção de doentes com IAM
Um número total de 50 doentes (n=50, M=35, F=15, entre os 40-60 anos de idade com dores no peito que duraram >120h participaram no estudo. Estes sujeitos foram admitidos na Unidade de Cuidados Intensivos da Faculdade e Hospital de Medicina de Calcutá. Os pacientes com diabetes mellitus ou infecção com risco de vida não foram incluídos no estudo. Como é sabido, a paricardite, embolia pulmonar, distúrbios aórticos e intestinais estimulam dores no peito devido a IAM ou SCA, os pacientes com estas condições foram cuidadosamente excluídos do estudo. Todos os participantes que foram hospitalizados com qualquer condição nos últimos seis meses ou pacientes que receberam aspirina dentro de 2 semanas foram excluídos do estudo.
Selecção de voluntários normais
Vários com idade e sexo iguais aos voluntários normais foram também incluídos no estudo. Nenhum dos voluntários normais tinha diabetes mellitus ou tinha qualquer história de hipertensão sistémica na apresentação. Nenhum dos voluntários normais tinha qualquer infecção com risco de vida ou tinha sido hospitalizado por qualquer condição nos últimos seis meses. Nenhuma das voluntárias tinha alguma vez recebido qualquer medicamento contraceptivo. Nenhum dos voluntários tinha tomado qualquer aspirina ou qualquer medicação cardíaca nas últimas 4 semanas.
Diagnóstico de IAM
Todos os pacientes com IAM foram admitidos na unidade de cuidados cardíacos intensivos do hospital com a característica de dor no peito, tal como descrito acima. Foram incluídos no estudo pacientes com IAM, tanto STEMI como não-STEMI. Todos os pacientes seleccionados tiveram ondas Q em desenvolvimento no ECG. Nos casos em que a ocorrência de ondas Q no ECG não pôde ser claramente demonstrada, foram excluídos do estudo. A ocorrência de IAM foi confirmada pelos níveis de pTi por ELISA.
Diagnóstico de ACS
Como parte do estudo pretendido, 30 pacientes (n=30, M=20, F=20) entre os 40-60 anos de idade foram incluídos no estudo. Estes pacientes apresentavam dores no peito características. Os pacientes que tinham bloqueio de ramo e as regiões de isquemia cardíaca não puderam ser determinadas pelo ECG foram excluídos do estudo.
A ocorrência de SCA foi confirmada pela determinação de CK-MB na amostra de sangue, retirando a amostra no prazo de 6h após a admissão no hospital.
As amostras de sangue no caso de IAM ou SCA foram obtidas dos sujeitos antes do início de qualquer terapia cardíaca para minimizar ambiguidade.
Protocolo de estudo
Os pacientes seleccionados foram aleatorizados e foi atribuído um número arbitrário a cada amostra de sangue de IAM, SCA e de voluntários normais e mantidos sob a supervisão de um funcionário que não era investigador. O investigador não tinha conhecimento se as amostras de sangue retiradas eram provenientes de um IAM ou ACS ou de um voluntário normal. Apenas após a conclusão do estudo, a “chave” da informação relativa ao estado do participante estava à disposição dos investigadores para análises estatísticas. Todas as amostras de sangue foram estudadas logo que possível após a retirada da amostra.
Preparação de plasma rico em plaquetas (PRP)
O PRP dos sujeitos foi preparado por centrifugação como descrito antes .
O plasma sem plaquetas (PFP) utilizado para a determinação de CK-MB ou pTi foi preparado por centrifugação das amostras de sangue a 10.000 g a 0°C .
Inibição de agregação de plaquetas por aspirina
Tipicamente, o PRP dos sujeitos com AMI, ACS ou dos voluntários normais foi incubado com aspirina de 80 µM durante 30 min a 37°C. A agregação de plaquetas foi iniciada tratando o PRP com 2 µM de ADP pré-incubado com ou sem aspirina . Em experiências de controlo, o PRP foi tratado com um volume igual de NaCl 0,9% incubado a 37°C durante 30 min.
Preparação da solução de aspirina
Solução de aspirina preparada a fresco foi feita dissolvendo a aspirina em água desionizada e o pH foi mantido a 7,0 pela adição de NaHCO3 0,1M. A solução de aspirina foi descartada após o uso.
Ensaio de troponina I e CK-MB
Os níveis de pTi e CK-MB foram determinados por ELISA usando o anticorpo Troponin I e o anticorpo CK-MB.
Análise estatística
Os resultados obtidos são apresentados como +/- desvio padrão, enquanto que o significado dos resultados foi determinado usando o teste t de Student. Os valores de p<0,05 foram considerados significativos. Quando apropriado, foram também determinados os coeficientes de correlação ® dos resultados de Pearson. A pontuação de Pearson “r”, é tal que -1 ≤ r ≤ +1 é aceitável onde os sinais (+) e (-) são designados como correlações lineares positivas e correlações lineares negativas, respectivamente. Software Graph Pad Prism (Graph Pad Software, San Diego, e EUA) e software Micro Cal origem 6.0 foram utilizados para as análises estatísticas. A avaliação do teste de diagnóstico e a análise da Curva do Operador Receptor (ROC) foi realizada utilizando software estatístico, MedCalc, Bélgica. De acordo com a análise ROC, um teste com discriminação perfeita (sem sobreposição em duas distribuições) tem uma curva ROC que passa pelo canto superior esquerdo (100% sensibilidade, 100% especificidade). Portanto, mais próxima a curva ROC está do canto superior esquerdo, maior é a exactidão geral do teste . A área sob curva (AUC) foi quantificada, o que é uma medida de quão bem um parâmetro pode distinguir entre dois grupos de diagnóstico (doente/normal).
Resultados
O efeito da aspirina na inibição da agregação plaquetária induzida pelo ADP em PRP dos sujeitos com ACS, AMI e dos voluntários normais
Quando o PRP destes sujeitos foi incubado com aspirina de 80 µM durante 30 min a 37°C e a agregação plaquetária foi iniciada tratando o PRP com 2.0µM ADP, verificou-se que apenas no caso do PRP dos sujeitos AMI, o composto não conseguiu inibir (0% de inibição) a agregação plaquetária. Em contraste, no caso de ACS (inibição percentual variando entre 52%-68%) ou no caso de PRP normal as plaquetas foram inibidas em 100% (Figura 1, Painel A). A análise da curva do operador receptor (ROC) mostrou 92% de sensibilidade (intervalo de confiança 95% (CI): 91,0-100,0) e 100% de especificidade (95% CI: 91,0-100,0, P<0,0001). A área sob curva (AUC), tal como testada pela análise ROC, passou a ser igual a 0,952 (Figura 1, Painel B).
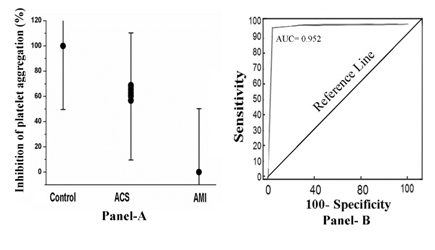
Figure 1. A percentagem de inibição da agregação de plaquetas e análise da curva do operador receptor em PRP por aspirina no caso de sujeitos normais, ACS e AMI. Painel A: O PRP de sujeitos normais, ACS e AMI foram preparados como descrito em Materiais e Métodos e incubados com aspirina de 80 µM durante 30 min a 37°C. Após incubação, a agregação plaquetária foi iniciada adicionando 2 µM de ADP e estudada num agregador óptico. Painel B: Análise da curva ROC da inibição da agregação plaquetária em que a sensibilidade é traçada contra a especificidade para diferentes pontos de corte. Cada ponto da curva ROC representa um par sensibilidade/especificidade correspondente a um determinado limiar de decisão, tal como descrito em Métodos e Materiais.
Relação entre o pTi e a inibição induzida pela aspirina da agregação plaquetária por ADP em AMI, ACS e em PRP normal.
Como mostrado na (Figura 2, Painel A), verificou-se que o aumento do pTi estava inversamente relacionado com a extensão da inibição induzida pela aspirina da agregação plaquetária. Por outras palavras, o aumento do pTi que foi máximo no caso do AMI também levou ao desenvolvimento da resistência máxima das plaquetas ao efeito inibidor da aspirina (Co-eficiente de correlação, r= -0,967 de Pearson, com p<0.001), e a inibição induzida pela aspirina da agregação plaquetária estava maximamente relacionada com a ausência total de pTi no normal e o nível de pTi no ACS era superior ao do plasma normal que a troponina I demostrada também estava presente no plasma ACS, embora menos do que no AMI. A curva do operador receptor (análise ROC) mostrou 85% de sensibilidade (intervalo de confiança 95% (CI): 81,0-92,0) e 78% de especificidade (95% CI: 75,0-80,0, P<0,0001). A área sob curva (AUC), tal como testada pela análise ROC, veio a ser igual a 0,739 (Figura 2, Painel B).
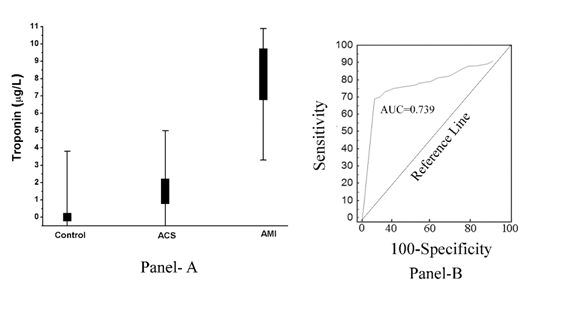
Figure 2. Nível de troponina I de plasma em indivíduos normais, ACS e AMI e a sua análise ROC. Painel A: O nível de pTi foi determinado por ELISA usando o anticorpo Troponina I, tal como descrito em Materiais e Métodos. Cada ponto é na realidade uma sobreposição de 50 doentes normais, 30 ACS e 50 AMI. Painel B: A análise da curva ROC dos níveis de pTi em doentes normais (não doentes), IAM (doentes doentes) foi construída utilizando MedCalc, tal como descrito em Métodos e Materiais.
Discussão
O enfarte agudo do miocárdio, alegadamente causado por trombose que resulta na morte de células cardíacas pode ser, sem dúvida, a doença trombótica mais perigosa que leva a um grande número de mortes entre as vítimas . Em contraste com as SCA, onde a recorrência da doença é relatada como sendo evitada pela aspirina através da inibição da agregação excessiva de plaquetas, as plaquetas no IAM são relatadas como sendo resistentes ao efeito inibidor do composto devido ao aparecimento da dermcidina isoform-2 (DCN-2) na circulação . Infelizmente, devido à falta de aspirina induzida pela inibição da agregação plaquetária, a maior parte das primeiras vítimas tiveram uma recorrência do AMI no espaço de meses e sucumbiram à condição. Como o DCN-2 foi reportado como sendo um potente inibidor da síntese de óxido nítrico induzido pela aspirina (NO) . Foi recentemente relatado que ao remover o DCN-2 ligado da superfície plaquetária através do aumento da síntese de NO em plaquetas, é possível ressensibilizar as plaquetas de AMI ao efeito da aspirina .
Não só o tratamento e prevenção do AMI através de intervenção terapêutica apropriada permanece problemático, mesmo o diagnóstico laboratorial da condição, diferenciado da ocorrência de ACS, permanece proibitivamente caro para muitos laboratórios no mundo, o que é normalmente necessário para a confirmação do AMI pelo nível de pTi. Isto deve-se ao facto de tanto a troponina I como o seu anticorpo serem não só caros, mas o próprio ensaio por ELISA necessita de equipamento especial e produtos químicos e suprimentos necessários que podem ser um procedimento moroso e em situação de necessidade em que uma ocorrência rápida e confirmatória de IAM é essencial para a intervenção terapêutica. Além disso, a interacção entre um antigénio e o seu anticorpo não segue a conhecida estequiometria química, e, como tal, o próprio ensaio pode apresentar problemas na validade da interpretação dos dados. Além disso, o diagnóstico de ACS, diferenciado do de AMI, pela determinação do plasma CK-MB por si só é um procedimento dispendioso.
Os resultados apresentados acima sugerem fortemente a viabilidade do diagnóstico de AMI, diferenciado da ocorrência de ACS, por simples agregometria plaquetária utilizando o aggregómetro de laboratório normal dentro de uma hora (Sensibilidade= 92% e Especificidade= 100% conforme determinado pela análise ROC). A curva do teste de diagnóstico, tal como descrita nos materiais e métodos, passa perto do canto superior esquerdo (Figura 1, Painel B), implicando uma precisão próxima dos 100% do teste de diagnóstico em comparação com o pTi (Figura 2, Painel B).
Também como a agregação de plaquetas no PRP não pode ser inibida pela aspirina no AMI, mas as plaquetas do PRP dos sujeitos do ACS poderiam ser, o diagnóstico do AMI por agregometria plaquetária poderia ser um evento i.e. a agregação de plaquetas do IAM poderia ou não ser alcançada pelo tratamento do PRP com aspirina, em contraste, a agregação de plaquetas dos doentes com SCA poderia ser inibida marcadamente pelo mesmo composto (Figura 1). No entanto, verificou-se que mesmo as plaquetas de ACS eram algo mais resistentes ao efeito inibidor da aspirina do que no caso de plaquetas normais. Por outro lado, as plaquetas de AMI eram maximamente resistentes ao efeito da aspirina que estava inversamente relacionado com os níveis de pTi (Coeficiente de correlação (r) entre o nível de pTi e % de inibição pela aspirina era -0.967, p<0.001).
Deve ser mencionado no contexto acima que é necessário um diagnóstico rápido e confirmatório de IAM para a utilização de terapia trombolítica que pode reduzir a taxa de mortalidade no IAM em 30-50% . Deve também notar-se que cerca de 50% dos doentes com aumento da pTi não têm elevação de ST ou ondas Q no ECG, e como tal, o diagnóstico agregométrico plaquetário do IAM poderia ser um método ainda mais útil de diagnóstico do que o ECG, e ao mesmo tempo é muito menos dispendioso do que o ELISA para a determinação da pTi.
A quantificação da pTi na circulação de doentes com IAM é geralmente realizada como uma proteína marcadora de confirmação do IAM. Contudo, num estudo preliminar verificou-se que a pTi era também um inibidor da síntese de NO e um potente indutor da agregação plaquetária nos intervalos (nM) semelhante aos níveis de pTi no plasma do AMI (não publicado). Contudo, como o nível plasmático de troponina I no ACS era superior ao do plasma normal, mas muito inferior ao do AMI, estes resultados sugeriram que o aumento de pTi também ocorreu no ACS, mas quase 6 vezes menos do que no AMI. Estes resultados sugeriram no entanto que o aumento do pTi em relação ao plasma normal por si só pode não confirmar necessariamente a ocorrência de AMI diferenciado da possível ocorrência de ACS.
Nós relatámos recentemente que a dor anginal característica no IAM estava relacionada com a redução severa do nível de NO no plasma que se devia à inibição da síntese de NO por DCN-2 ou outros inibidores sistémicos de óxido nítrico sintase . Como o pTi foi considerado um novo agente agregador plaquetário (não publicado), através da inibição da NOS em plaquetas, é possível que o próprio pTi possa estar envolvido na dor anginal, pelo menos em parte, no IAM. O derrame de pTi na circulação dos músculos cardíacos poderia ser trombogénico por si só e contribuir para o desenvolvimento da resistência ao efeito inibidor da aspirina nas plaquetas do IAM semelhante ao efeito do DCN- 2, resultando no início ou no agravamento da condição. E assim, a própria presença de pTi pode ter um papel sinistro no desenvolvimento da resistência ao efeito inibidor da aspirina nas plaquetas em AMI, levando à recorrência da condição.
- Colman RW, Walsh PN (1987) Hemostasia e trombose. In: Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphia, PA (EUA), J.B. Lippincott: 594-605.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inhibition of human blood platelet aggregation and the stimulation of nitric oxide synthesis by aspirin. Plaquetas 14: 421-427.
- Zweig MH1, Campbell G (1993) Plots Receiver-operating Characteristic (ROC): um instrumento de avaliação fundamental em medicina clínica. Clin Chem 39: 561-577.
- Bank S, Jana P, Maiti S, Guha S, Sinha AK (2014) Dermcidin isoform-2 induziu a anulação do efeito do ácido acetil salicílico na agregação plaquetária no enfarte agudo do miocárdio. Rep. Ciência 4: 5804.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Redução da taxa de mortalidade devido a enfarte agudo do miocárdio em indivíduos com cancros através da restauração sistémica do óxido nítrico debilitado. PLoS One 9: e88639.
li>Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Ruptura da placa, trombose, e implicações terapêuticas. Hemóstase 4: 269-284. Página DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) Alterações miocárdicas associadas ao choque cardiogénico. N Engl J Med 285: 133-137.
li>Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) O aparecimento da dermcidina isoforma 2, um novo agente agregador plaquetário na circulação no enfarte agudo do miocárdio que inibe a síntese da insulina e a restauração dos seus efeitos pelo ácido acetilsalicílico. J Thromb Thrombolysis 31: 13-21.li>Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Redução na dispersão do intervalo QT através de uma terapia trombolítica bem sucedida no enfarte agudo do miocárdio. Investigadores do Estudo TEAM-2. Circulação 90: 94-100.