Lewis structure of carbonate ion is drawn in this tutorial step by step. O conceito de electrões de valência total é utilizado para desenhar a estrutura de Lewis do CO32-. Após terminar a estrutura de lewis do CO32-, deve haver uma carga de -2 e uma estabilidade. Aprenderá sobre estas coisas neste tutorial.
br>
Ion de carbonato | CO32-
Ion de carbonato tem uma carga -2. Os compostos de carbonato metálico são comuns no mundo. Como um CaCO3 pode ser dado.
h2>CO32- Lewis structure 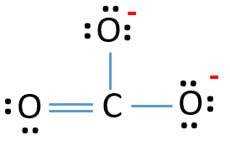 br>>p>Há três ligações σ e π ligação em torno do átomo de carbono na estrutura Lewis do ião CO32.
br>>p>Há três ligações σ e π ligação em torno do átomo de carbono na estrutura Lewis do ião CO32.
h2>Passos de desenho da estrutura de Lewis de CO32-
Passos seguintes são necessários para desenhar a estrutura de CO32- lewis e são explicados em detalhe neste tutorial.
- Ponham o número total de electrões das conchas de valança dos átomos de carbono e oxigénio
- Pares de electrões totais
- Selecção do centro do átomo
- Ponham pares solitários nos átomos
Verifica a estabilidade e minimiza as cargas nos átomos convertendo pares solitários em ligações.
p>Desenhar uma estrutura lewis correcta é importante para desenhar estruturas de ressonância de CO32- correctamente.
h3>Número total de electrões das conchas de valança de CO32-
Carbon está localizado no grupo 4 na tabela periódica. Assim, o carbono tem quatro electrões na sua concha de valência. O oxigénio está localizado no 6º grupo. Tem seis electrões na sua concha de valência.
>br>
Existem três átomos de oxigénio no ião de CO32, Portanto
- Total dos electrões de valência dados pelos átomos de oxigénio = 6 *3 = 18
Existem -2 cargas no ião de CO32. Portanto, há mais dois electrões que contribuem para os electrões de valência.
- Total de electrões de valência = 4 + 18 + 2 = 24
Total de pares de electrões de valência
Total de pares de electrões de valência = σ bonds + π bonds + pares isolados em conchas de valência
Total de pares de electrões são determinados dividindo o número total de electrões de valência por dois. Para, CO32-ion, os pares totais de electrões são 12,
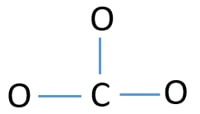
Atoma central de CO32-ion
Para ser o átomo central, a capacidade de ter valências mais altas é importante. O carbono tem mais hipóteses de ser o átomo central (Ver figura) porque o carbono pode mostrar valência de 4. A valência mais alta do oxigénio é de 2. Assim, agora podemos construir um esboço de ião CO32.
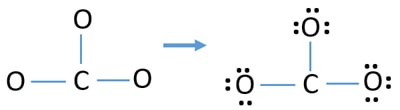
Pares isolados em átomos
- Já existem três ligações C-O no esboço acima. Portanto, restam apenas nove (12-3 = 9) pares de electrões de valência.
- Primeiro, marcar esses nove pares de electrões de valência como pares solitários em átomos exteriores (em átomos de oxigénio). Um átomo de oxigénio levará três pares isolados seguindo a regra octal (o átomo de oxigénio não pode manter mais de oito electrões na sua concha de valência).
- Para três átomos de oxigénio, são gastos nove pares de electrões. Agora não há mais pares isolados para marcar nos átomos de carbono após marcação nos átomos de oxigénio (átomos exteriores).
Carga nos átomos
Após marcação dos pares de electrões nos átomos, devemos marcar as cargas de cada átomo. A marcação de cargas é significativa porque é utilizada para determinar a melhor estrutura de lewis do ião. Depois de marcar as cargas, verá, cada átomo de oxigénio receberá uma carga -1 e o átomo de carbono receberá uma carga +1.
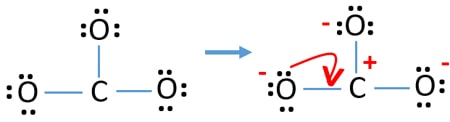
Verificar a estabilidade e minimizar as cargas sobre os átomos convertendo pares isolados em ligações
- Os átomos de oxigénio devem ter cargas negativas porque a electronegatividade do átomo de oxigénio é superior à do átomo de carbono. Caso contrário, podemos dizer que a capacidade de manter cargas negativas é maior nos átomos de oxigénio do que nos átomos de carbono.
- A estrutura desenhada não é estável porque todos os átomos têm uma carga (a estrutura de Lewis deve ser estável com menos cargas).
- li>Agora, devemos tentar minimizar as cargas convertendo pares ou pares isolados em ligações. Assim, converter um par ou pares isolados de um átomo de oxigénio para fazer uma ligação C-O.
- Agora existe uma ligação dupla entre um átomo de carbono e um átomo de oxigénio (uma ligação C=O). Agora, há duas ligações únicas entre o átomo de carbono e outros dois átomos de oxigénio (duas ligações C-O).
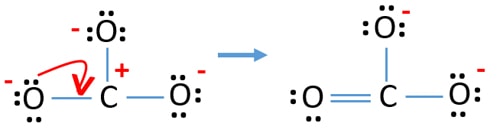
Na nova estrutura, as cargas de átomos são reduzidas do que na estrutura anterior. Agora não há carga sobre um átomo de oxigénio e sobre o átomo de carbono. Além disso, apenas dois átomos de oxigénio têm -1 cargas negativas. Agora compreende-se que esta estrutura de CO32- é mais estável do que a estrutura anterior. Portanto, esta estrutura tem mais hipóteses de ser a estrutura de lewis do ião CO32-.
br>>h2>Lewis estrutura de CO32-ion (carbonato) ion 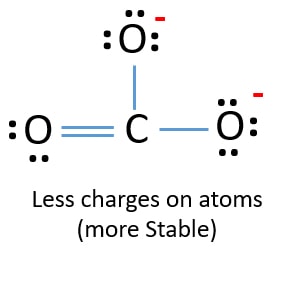 br>>p>Questõesbr>Escreva as suas questões de química e encontre as respostas
br>>p>Questõesbr>Escreva as suas questões de química e encontre as respostas
h4>carbonato estrutura de lewis e bicarbonato estrutura de lewis
In carbonato ion, há dois átomos de oxigénio que têm -1 carga em cada um deles. Um destes átomos de oxigénio toma um próton (ião H+) e forma um grupo -OH.
br>Tutoriais relacionados