Propriedades dos Compostos Iónicos
Porque todos os compostos iónicos são formados quando os ânions e catiões são atraídos uns pelos outros, os compostos iónicos têm frequentemente características semelhantes.
Os compostos iónicos formam cristais
Os compostos iónicos consistem em catiões e ânions que se colam uns aos outros por causa das suas cargas opostas. Imagine um único cátion de lítio colado ao lado de um único ânion de cloro para formar cloreto de lítio. Agora, é improvável que apenas um ião de lítio e um ião de cloreto estejam presentes neste local?geralmente, quando falamos de reacções químicas, estamos a falar de um enorme número de átomos que sofrem uma reacção num local muito pequeno (uma colher de chá de sal contém aproximadamente 1022 átomos). Como resultado, se o nosso único par LiCl se aproximasse de outro par LiCl, ocorreria o seguinte:
Porque os iões carregados de forma oposta atraem-se uns aos outros, os pares LiCl tenderão a formar grupos maiores. Estes grupos maiores, por sua vez, formarão grupos ainda maiores de iões, como mostra a figura seguinte:
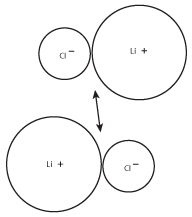
Figure 8.3A carga positiva no cátion de lítio de um par será atraída para a carga negativa no ião cloreto do outro par.

Figure 8.4 Este processo, onde pilhas de iões LiCl se combinam umas com as outras, continuará até que não haja mais iões de lítio ou cloreto.
Cristais são grandes arranjos de iões ou átomos que são empilhados em padrões regulares. Muitos compostos iónicos formam cristais muito grandes.
Estes grandes arranjos de iões são referidos como cristais. Embora os cristais sejam frequentemente formados a partir de compostos iónicos, eles também existem em alguns outros compostos químicos, tais como diamantes. Falaremos disto com muito mais detalhe em Sólidos.
Hydrates são formados quando uma ou mais moléculas de água se ligam a compostos iónicos. Estes compostos são interessantes porque parecem secos mas libertam água quando aquecidos. Particularmente interessante é o sal de Epsom, ou sulfato de magnésio hepta-hidratado (MgSO47H2O). Quando aquecido, dá-se água suficiente para dissolver realmente o sulfato de magnésio!
Compostos iónicos Têm frequentemente pontos de fusão e ebulição elevados
O que acontece quando aquece algo na sua cozinha? Pode ter descoberto ao cozinhar (ou ao micro-ondas ao acaso enquanto está aborrecido) que a maioria dos alimentos que comemos ou derretem ou queimam quando aquecidos. Alguns alimentos até fazem as duas coisas! Como pode provavelmente adivinhar, sou um especialista quando se trata de apagar fogos domésticos.
Compostos iónicos, por outro lado, derretem e fervem frequentemente a temperaturas muito mais elevadas do que outros materiais. Para que os compostos iónicos derretam, deve ser adicionada energia suficiente para que os cátions e os ânions se afastem uns dos outros. Devido a estas atracções serem tão fortes, é necessária muita energia para afastar estes iões. Adicionar esta quantidade de energia aos compostos iónicos requer uma grande quantidade de calor, razão pela qual os compostos iónicos têm pontos de fusão e ebulição muito elevados.
Os Compostos iónicos são duros e quebradiços
Imagine esmagar um grande pedaço de cloreto de lítio contra a sua cabeça. Como é que supõe que isso possa parecer? Se adivinhasse que iria doer como uma loucura, tinha razão. Como muitos compostos iónicos, o cloreto de lítio é tão duro como uma rocha.
Os compostos iónicos são extremamente duros porque é difícil fazer com que os iões se separem uns dos outros num cristal. Mesmo que se aplique uma grande força sobre o cristal (imagine correr de cabeça numa parede gigante de cloreto de lítio), a atracção entre os cátions e os ânions continuará frequentemente a manter o cristal unido.
Vamos dizer, no entanto, que se quer realmente separar um composto iónico. Embora muito duros, os compostos iónicos também são frequentemente muito frágeis, o que significa que se desfazem quando é aplicada a força certa. Como mostra a figura seguinte, onde se aplica a força é tão importante como quanta força se utiliza.

Figure 8.5 Aplicando força de uma forma que separa os cátions e os ânions uns dos outros: pode causar a quebra completa de um cristal.
Como pode ver neste diagrama, os cristais iónicos alinham-se de tal forma que há regiões onde uma pequena força pode quebrar o cristal. Estas regiões são por vezes referidas como “planos de clivagem” porque são os locais onde o cristal é mais fraco e pode mais facilmente ser quebrado.
Compostos iónicos Conduzem a Electricidade Quando Dissolvidos em Água ou Derretidos
Após um tempo, houve um inventor que inventou um dispositivo para secar o cabelo. Este “secador de cabelo”, como ele lhe chamou, aqueceu o ar com electricidade e soprou-o através do cabelo da pessoa que o segurava. Como a água evapora quando aquecida, o cabelo seca mais rapidamente. O legado deste inventor vive até hoje num aparelho doméstico amado por milhões.
Electrolitos são compostos que conduzem a electricidade quando dissolvidos em água. Muitos compostos iónicos são considerados como electrólitos. No entanto, alguns compostos iónicos não se dissolvem na água. Como resultado, não partilham esta propriedade.
Pouco depois, houve um tipo que decidiu que não queria esperar para sair da banheira antes de secar o seu cabelo. O seu legado: Um autocolante de aviso do secador de cabelo com uma fotografia de um tipo a ser electrocutado.
Quando são colocados compostos iónicos na água, eles fazem com que a água conduza electricidade. Normalmente, a água não conduz electricidade de forma alguma. No entanto, quando os sais se dissolvem na água, decompõem-se nos seus cátions e ânions constituintes e é a presença destes iões que lhe permite conduzir a electricidade. Porque os sais conduzem electricidade quando dissolvidos na água, são referidos como electrólitos.
Da mesma forma, os sais puros também conduzem electricidade quando são derretidos. Como sólidos, os ânions e catiões de um composto iónico são bloqueados no local e incapazes de mover carga eléctrica. No entanto, quando o composto iónico é derretido, estes iões são livres de se moverem e conduzir carga.
Excerpted from The Complete Idiot’s Guide to Chemistry 2003 de Ian Guch. Todos os direitos reservados, incluindo o direito de reprodução no todo ou em parte, sob qualquer forma. Usado por acordo com Alpha Books, um membro do Penguin Group (USA) Inc.
Para encomendar este livro directamente à editora, visite o website do Penguin USA ou ligue 1-800-253-6476. Também pode adquirir este livro em Amazon.com e Barnes & Noble.