A FDA e o CDC, em colaboração com parceiros estatais e locais, concluíram a investigação de dois dos três surtos multiestatizados de infecções por E. coli O157:H7 nos EUA neste Outono.
Uma destas investigações, Outbreak Unknown Source 3, identificou 18 doenças notificadas em nove estados: Califórnia, Colorado, Illinois, Michigan, Nova Iorque, Ohio, Pennsylvania, Virginia, Washington.
FDA concluiu uma investigação de rastreio de vários veículos alimentares potenciais identificados em entrevistas a doentes e embora nenhuma exploração agrícola tenha sido identificada como uma fonte comum do surto, a FDA e os parceiros estatais também conduziram investigações no local em explorações agrícolas de interesse. No entanto, as informações e amostras recolhidas nestas inspecções não estabeleceram uma ligação entre estas explorações agrícolas e o surto. A investigação de uma exploração não significa que a exploração esteja ligada a um surto. Os resultados de uma investigação numa exploração agrícola podem muito bem levar a que essa empresa seja excluída da investigação. A 12/18/2020, o CDC anunciou que este surto tinha terminado.
A outra investigação de surto concluída, Outbreak Unknown Source 1, identificou 32 doenças notificadas em 12 estados: Califórnia, Illinois, Louisiana, Maryland, Michigan, Montana, New Jersey, Ohio, Utah, Virginia, Washington, Wisconsin. Esta estirpe de E. coli é geneticamente semelhante a uma estirpe ligada a um surto de romaine que ocorreu na Primavera de 2018, embora um alimento não estivesse ligado ao actual surto. A FDA concluiu uma investigação de rastreio e foi incapaz de determinar uma fonte comum do surto. A FDA e os parceiros estatais também realizaram inspecções no local em explorações agrícolas de interesse, embora a informação recolhida nestas inspecções não tenha ligado estas explorações ao surto. A 12/18/2020, o CDC anunciou que este surto tinha terminado.
Investigações de um terceiro surto de E. coli de Origem Desconhecida 2 continuam.
Recomendação
Consumidores, restaurantes, e retalhistas, foram aconselhados a não comer, vender, ou servir Tanimura recordada Antle, Inc., marca Antle, Inc. embalada com uma única cabeça de alface romana com uma data de embalagem de 15/10/2020 ou 16/10/2020.
Os produtos recolhidos estão agora muito para além do prazo de validade e provavelmente já não estão no mercado ou em casa dos consumidores.
Fotos do produto

Recall Information
Em 6 de Novembro de 2020, Tanimura Antle, Inc. recordada alface romana de cabeça única sob a Tanimura Marca Antle, rotulada com uma embalagem na data de 15/10/2020 ou 16/10/2020, devido a possível contaminação com E. Coli O157:H7. As embalagens contêm uma única cabeça de alface romana com o número UPC 0-27918-20314-9.
De acordo com Tanimura Antle, o produto potencialmente afectado foi distribuído para os seguintes estados AK, OR, CA, TX, AR, OK, IN, NE, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR, e IL, mas o produto poderia ter sido distribuído, atingindo estados adicionais, incluindo MI.
O produto foi enviado em caixas embaladas em 12, 15, 18 ou 24 cabeças por caixa. Os retalhistas e distribuidores podem identificar os produtos potencialmente afectados através do autocolante da Iniciativa de Rastreabilidade do Produto (Produce Traceability Initiative – PTI) aposto no exterior da caixa. Os códigos PTI são 571280289SRS1 e 571280290SRS1.
U.S. Distribution Map of Recalled Tanimura Antle, Inc. Alface romana de cabeça única
Distribuição do produto*: AK, OR, CA, TX, AR, OK, IN, NE, MI, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR, IL
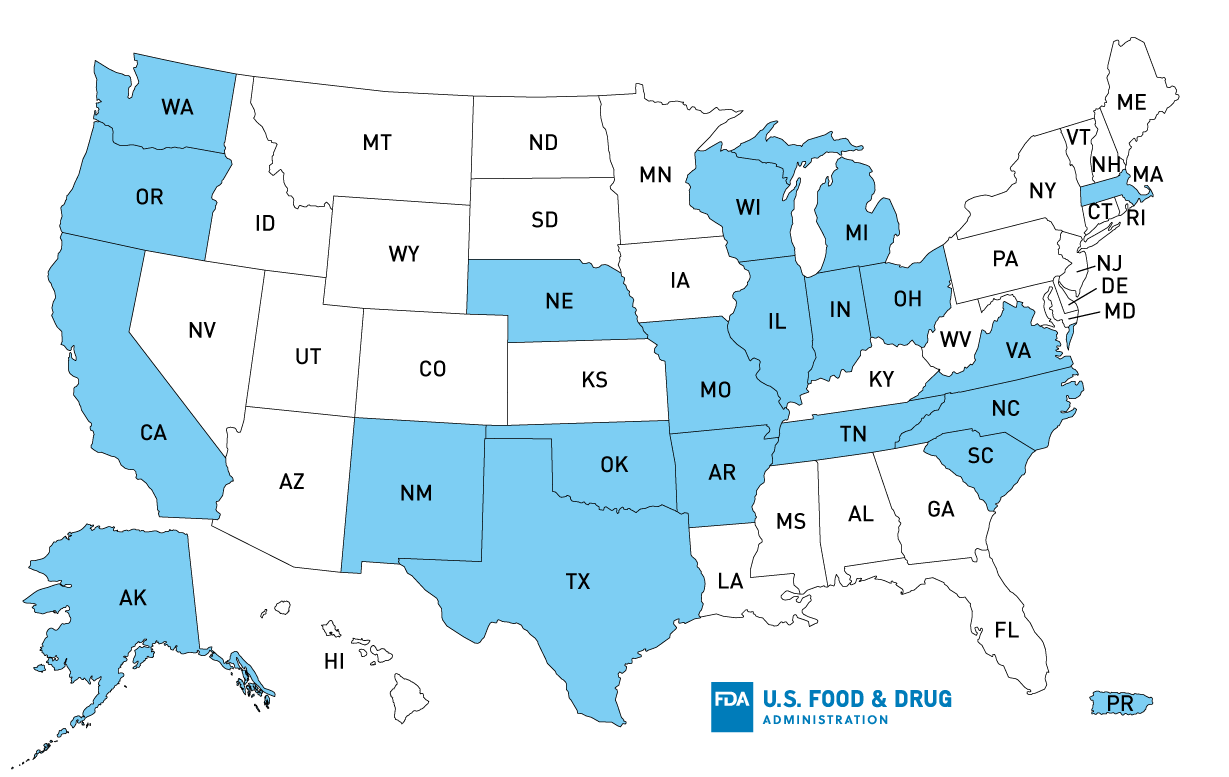
*Estados com distribuição confirmada; o produto poderia ter sido distribuído mais tarde
Contagens de casos
Para estes surtos, as contagens de casos são encontradas no website do CDC:
- Página de Outbreak do CDC: Fonte Desconhecida 1
- A Página de Surto do CDC: Fonte Desconhecida 2
- CDC’s Outbreak Page: Fonte Desconhecida 3
Actualizações Anteriores
12 de Novembro de 2020
A FDA e o CDC, em colaboração com parceiros estatais e locais, estão a investigar doenças num terceiro surto de E. multiestados.coli O157:H7 infecções neste Outono.
A 6 de Novembro de 2020, o Departamento de Agricultura e Desenvolvimento Rural de Michigan (MDARD) relatou que, como parte da amostragem de rotina, recolheu uma amostra de produto de alface romana para testes. A amostra testada deu positivo para E. coli O157:H7 e subsequente análise de sequenciação do genoma inteiro (WGS) determinou que a E. coli O157:H7 presente nas amostras corresponde à estirpe que causou doenças neste surto.
A estirpe de E. coli O157:H7 coli encontrada na amostra de Michigan é uma terceira estirpe distinta não geneticamente relacionada com as estirpes que causaram dois surtos distintos de E. coli O157:H7 (STEC) que a FDA e o CDC anunciaram em 28 de Outubro de 2020. Neste momento, um alimento específico não foi ligado a nenhum desses surtos.
Em 6 de Novembro de 2020, Tanimura Antle, Inc. recordou alface romana de cabeça única embalada com uma data de embalagem de 10/15/2020 ou 10/16/2020 devido a possível contaminação com E. coli O157:H7. A firma recordou este produto com base nos resultados de testes de uma amostra de produto recolhida e analisada por MDARD antes da análise WGS mostrando a correspondência com a estirpe do surto.
FDA e parceiros estatais estão a trabalhar com a firma para determinar se a romaine adicional deve ser recordada.
Neste momento, não existem provas epidemiológicas e de traços suficientes para determinar se as pessoas doentes neste surto foram expostas a alface romana de Tanimura Antle, Inc. Será fornecida informação adicional à medida que se tornar disponível.
Quem contactar
Consumidores que tenham sintomas devem contactar o seu fornecedor de cuidados de saúde para relatar os seus sintomas e receber cuidados.
Para comunicar uma queixa ou evento adverso (doença ou reacção alérgica grave), pode
- Chamar um Coordenador de Reclamações do Consumidor da FDA se desejar falar directamente com uma pessoa sobre o seu problema.
- Completar um formulário electrónico MedWatch Voluntário on-line.
- Completar um formulário MedWatch Voluntário em papel que pode ser enviado para a FDA.