- Fundo
- Etiologia
- Epidemiologia
Défice combinada de factores de coagulação dependentes da vitamina K (VKCFD) surge apenas raramente como uma condição congénita. A VKCFD congénita é herdada como uma de duas variantes; ambas são doenças hemorrágicas autossómicas recessivas raras. A apresentação clínica mais comum de actividade deficiente combinada de factores de coagulação II (FII), FVII, FIX e FX (e proteínas C, S e Z) ocorre devido a deficiência de vitamina K adquirida, em particular resultante de doença hepática, má absorção ou má nutrição, ou associada a uma série de medicamentos, sobretudo sobredosagem de varfarina ou derivados de varfarina.
A função de cada uma das proteínas dependentes da vitamina K (VKDP) depende da gama normal (Ƴ)-carboxilação de um número de resíduos de ácido glutâmico na região amino-terminal das proteínas (o Domínio Gla).1 Esta reacção requer ciclos normais de vitamina K desde a sua forma reduzida até ao estado oxidado, seguidos da regeneração da vitamina K.2 reduzida, 3 Estas reacções são realizadas através da acção de duas enzimas reticuladas endoplasmáticas (ER): a Ƴ-glutamil carboxilase (GGCX) e a subunidade do complexo de vitamina K 2,3 epoxídica redutase1 (VKORC1). As duas variantes de VKCFD surgem devido a defeitos nos genes que codificam estas duas proteínas e não devido a defeitos intrínsecos nos factores de coagulação. A actividade deficiente de GGCX resulta em VKCFD1 enquanto que a actividade deficiente de VKORC1 leva a VKCFD2. A apresentação clínica mais comum de VKCFD é hemorragia grave durante a infância, embora o grau de deficiência seja altamente variável e a apresentação de VKCFD possa ocorrer durante toda a infância e na idade adulta.4,5 Além disso, há um reconhecimento crescente de que a subcarboxilação e função deficiente do VKDP que afecta os sistemas biológicos fora da coagulação é comum na VKCFD, é altamente variável na apresentação, e pode apresentar características clínicas consideravelmente mais tardias na vida do que o fenótipo hemorrágico, com implicações na vigilância e gestão da VKCFD.
McMillan e Roberts descreveram o primeiro caso de hemorragia clínica resultante de deficiência congénita Ƴ-carboxilação em 1966.6,7 A criança do sexo feminino de uma gravidez não complicada manifestou hematomas a partir da idade de 1 semana, com hemorragias serosanguíneas recorrentes do coto umbilical ao longo dos primeiros meses de vida. Na apresentação o seu tempo de protrombina (PT) foi de 95 segundos e o seu tempo de tromboplastina parcial (PTT) foi de 305 segundos. Ao misturar o plasma da paciente numa proporção de 1:1 com plasma normal, cada um destes testes foi completamente corrigido para o intervalo normal e clinicamente o seu sangramento umbilical parou após uma única infusão de plasma fresco congelado (FFP). Enquanto a contagem de plaquetas, fibrinogénio, e FV e FVIII estavam normais, a actividade de FII, FVII, FIX e FX estavam todos abaixo do limite inferior de detecção (<3%). Na instituição de um programa de terapia diária com vitamina K1 enteral, a criança cresceu e desenvolveu-se normalmente apenas com uma ligeira tendência para contusões. Uma interrupção da terapia com vitamina K1 durante um período de 9 dias resultou no regresso de hematomas graves marcados.
Durante o meio século subsequente, os diagnósticos de VKCFD têm sido extremamente raros. A colecção mais abrangente de casos notificados de VKCFD1 (defeito genético de GGCX associado a baixos factores de coagulação VKDP) inclui menos de 30 tipos; 5,7 quatro famílias com VKCFD2 foram descritas.8 O grau de deficiência é variável entre os casos notificados. A combinação particular de FII, FVII, FIX e FX deficiente resulta em múltiplos níveis de geração de trombina defeituosa. A actividade do substrato protrombina é ela própria deficiente, e adicionalmente a geração de trombina através do Factor Tecidular/FVIIa e através do complexo tenase é deficiente. A carência de proteínas em cada uma das vias intrínsecas, extrínsecas e comuns da cascata de coagulação reflecte-se no prolongamento dos testes de rastreio do PT e do aPTT. O prolongamento do TP pode ser mais marcado do que o prolongamento do aPTT em casos mais suaves. Ƴ-carboxilação é também necessária para a função normal das proteínas anticoagulantes C, S, e Z; contudo, a apresentação comum e as complicações graves da VKCFD resultam de hemorragia e não de trombose.9
A etiologia completa da VKCFD tornou-se clara após a clonagem e caracterização do gene que codifica a proteína GGCX por Stafford e colegas em 199110,11 Stafford e colegas e Oldenburg e colegas em 2004.12,13,14 Os estudos de pedigree subsequentes levaram à designação das duas variantes: VKCFD1, resultante de mutações no gene Ƴ-glutamil carboxilase (GGCX), e VKCFD2, resultante de mutações no gene do complexo VKOR (VKORC1, ou VKOR).15,16,17
Vitamina K existe em 3 formas:
- Vitamina K1 (filoquinona), uma importante vitamina dietética, é produzida por plantas e algas e está presente em grandes quantidades em vegetais verdes e de folhas. Juntamente com as vitaminas A, D, e E, a vitamina K1 é uma vitamina lipossolúvel.
- Florma microbiana intestinal normal produz vitamina K2 (menaquinonas).
- Uma forma sintética de vitamina K foi derivada como um agente farmacológico com maior solubilidade em água e designada vitamina K3 (menadiona).
As proteínas dependentes da vitamina K contêm todas um domínio Gla rico em ácido carboxiglutâmico Ƴ, e o papel da vitamina K como co-factor na modificação pós-tradução adequada deste domínio é fundamental para a sua função normal. Para além das proteínas envolvidas na coagulação, é cada vez mais apreciado que uma variedade de processos biológicos sejam afectados por proteínas dependentes da vitamina K (VKDP) e a expressão fenotípica da sub-carboxilação pode estar associada a manifestações hemorrágicas e não hemorrágicas. (Ver “Manifestações clínicas”) Para além do envolvimento das proteínas anti-coagulantes C e S na inflamação, a acção da proteína rica em Gla (GRP) nos monócitos/macrófagos está envolvida na interacção entre inflamação e calcificação. A osteocalcina VKDP derivada do osteoblasto está envolvida no metabolismo da glucose e associada à formação óssea normal e à força óssea. VKDP adicionais estão envolvidos na regulação da proliferação celular (proteína 6 do gene Growth Arrest Specific Gene, Gas6) e com a inibição da calcificação vascular e mineralização dos tecidos (proteína Gla matriz, MGP), enquanto que a função de vários VKDP adicionais são actualmente desconhecidos, incluindo as proteínas Gla transmembrana (TMG) e as proteínas Gla rica em prolina (PRGP).2,18, 19, 20
Factores de coagulação II, VII, IX e X e as proteínas C, S e Z contêm entre 9 e 13 glutamatos (Glu) na sequência de aminoácidos dos seus respectivos domínios Gla. A modificação pós-tradicional insuficiente destes glutamatos para Ƴ-carboxi ácido glutâmico (Gla) é o passo enzimático defeituoso em ambas as variantes de VKCFD. A carboxilação do domínio Gla confere uma conformação dependente do cálcio que é crítica para a interacção normal das proteínas com fosfolípidos (por exemplo, com a superfície fosfolípida da plaqueta activada) ou com células endoteliais. O GGCX é a proteína que realiza esta modificação pós-tradicional; no entanto, a vitamina K na sua forma reduzida é também necessária para actuar como co-factor. A vitamina K reduzida é convertida em vitamina K epoxídica no decurso da reacção, e a forma reduzida deve ser regenerada para ciclos adicionais de catálise através da acção de VKOR. A VKOR é oposta pela warfarina anticoagulante, de modo que um indivíduo que tome warfarina tenha prejudicado a regeneração da vitamina K reduzida, com um resultado controlado semelhante à deficiência de vitamina K ou VKCFD: excesso subcarboxilado e funcionalmente deficiente FII, FVII, FIX, e FX. 2,3 Os ciclos de vitamina K podem ser visualizados como mostrado na Figura 1.
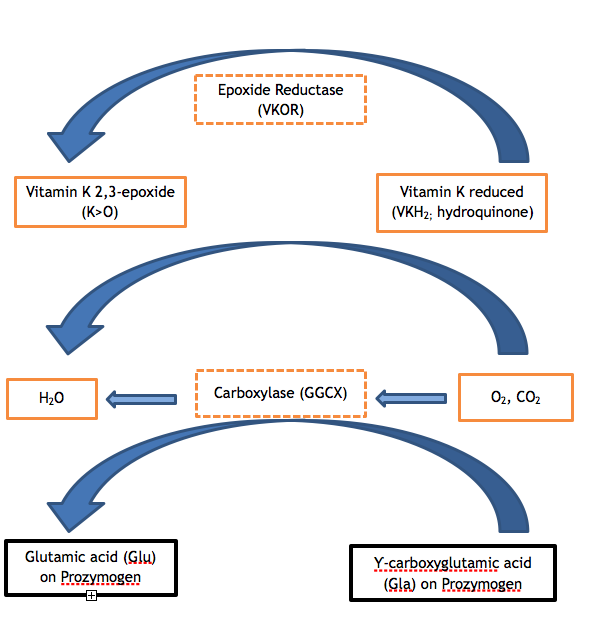
Figure 1. O Ciclo da Vitamina K. A carboxilação dos resíduos de ácido glutâmico das proteínas dependentes da vitamina K do zymogen é necessária para o seu bom funcionamento. A carboxilase (GGCX) adiciona uma molécula de dióxido de carbono ao Glu para formar Gla numa reacção para a qual a vitamina K é um co-factor essencial. A forma reduzida de vitamina K (hidroquinona) é oxidada no processo, produzindo vitamina K 2,3-epóxido. A vitamina K reduzida deve ser regenerada a partir da epóxida pela acção enzimática de VKOR, para que a vitamina K reduzida esteja disponível para servir de co-factor para reacções de carboxilação subsequentes. A actividade deficiente de qualquer das enzimas VKOR ou GGCX (ver caixas hachuradas na figura) resulta em VKCFD.
É evidente nesta discussão que enquanto os VKDPs são sintetizados e secretados normalmente, a função proteica é anormal como resultado de uma carboxilação pós-tradução insuficiente.
A purificação de GGCX e VKORC1, que são proteínas de membrana integral, tem sido um desafio e as estruturas cristalinas destas proteínas ainda não estão resolvidas. No entanto, está a emergir uma compreensão dos domínios funcionais destas proteínas.1 Este esforço é complementado por esforços recentes para correlacionar defeitos genéticos que afectam regiões específicas das enzimas com a gravidade e o espectro de actividade deficiente do VKDP, tanto no sistema de coagulação como em outros processos fisiológicos. 5,8,21,22
O gene GGCX no braço p do cromossoma 2 codifica uma proteína transmembrana de 758 aminoácidos (AA) que está localizada na membrana do retículo endoplasmático. A porção N-terminal da enzima é citoplásmica. Seguem-se cinco domínios transmembrana, localizados na membrana lipídica da ER. A porção C-terminal da proteína é intralumenal na ER. A região intralumenal contém domínios hidrofóbicos importantes para interagir com a vitamina K. Um domínio funcional importante (proposto para ser AA 491-507) interage com o propéptido do VKDP, enquanto outra região de ligação (AA 393-404) para o glutamato do VKDP facilita a gama-carboxilação. De facto, a primeira correlação do fenótipo clínico do VKCFD com uma mutação no gene GGCX descreveu uma substituição de leucina por arginina na posição 394 da região de ligação do glutamato.15 Embora a sequência dos primeiros quatro domínios transmembrana do GGCX seja altamente conservada evolutivamente, a sua função nos seres humanos não é conhecida. A proteína aqui descrita é expressa a partir do gene GGCX de comprimento total. Uma isoforma 2 do mRNA do GGCX que não tem exon 2 (Δ2GGCX) pode codificar uma proteína que retém a actividade enzimática, embora o significado fisiológico desta isoforma não esteja determinado (ver também “Herança e Mutações Causais”).23
O gene cromossoma 16 VKOR codifica uma proteína transmembrana de 163 AA. A topologia básica da membrana da proteína VKOR é controversa: por exemplo, continua o debate se a proteína tem três ou quatro domínios transmembrana, e se o sítio activo altamente conservado VKOR C132XXC135 para o ataque nucleófilo da Vitamina K é citoplasmático ou dentro do lúmen ER. Uma região estrutural importante envolve as moitas argininas em AA 98 e 100 constituem um motivo de retenção de di-arginina ER que é necessário para manter o VKOR localizado no local de actividade requerido. Uma única mutação VKOR (VKORC1p.Arg98Trp) contabiliza todos os casos de VKCFD2, pelo que não existe a oportunidade de correlações genótipo/fenótipo para informar a compreensão das interacções enzimáticas funcionais da redutase (análoga às possibilidades que existem com o VKCFD1). 1,8,24,25
Existe a possibilidade de genes adicionais que modificam a acção destas proteínas poderem ainda não estar identificados. Dados animais sugerem que uma via independente e redundante de carboxilase não existe em todos os tecidos, no entanto, à luz da letalidade embrionária tanto do nocaute de GGCX como do nocaute de VKOR em ratos.26,27 No momento da identificação da proteína VKOR, Rost e colegas identificaram uma proteína paralógica rotulada como VKOR 1 (VKORL1), que é capaz de reduzir K>O;13 foi sugerido um papel para VKORL1 no resgate de alguma função da vitamina K em tecidos extra-hepáticos durante a anticoagulação com antagonistas de vitamina K.1 Não há dados que sugiram que o VKORL1 tem um papel fisiológico significativo no apoio à carboxilação hepática dos factores de coagulação, pelo que se pensa que a proteína paraleolar não é relevante para a VKCFD neste momento.
VKCFD é muito rara. A colecção mais completa de casos publicados de VKCFD1 (em que uma mutação genética no GGCX está presente em associação com a diminuição da actividade do factor de coagulação) inclui 33 indivíduos afectados (26 probandos separados).5 Não foi descrita qualquer influência de raça ou etnia, e foram relatados casos de África, Ásia, Europa, América do Norte e América do Sul.7,21,28 O VKCFD2 é mais raro, com 10 casos relatados de quatro famílias de origem norte-americana caucasiana, alemã, italiana e libanesa.8