Como funcionam os tampões
Como se viu no cálculo do pH das soluções, apenas uma pequena quantidade de um ácido forte énecessária para alterar drasticamente o pH. Para certas experiências, contudo, é desejável manter um pH razoavelmente consistente enquanto ácidos ou bases são adicionados à solução quer por reacção quer pelo experimentador. Os tampões são concebidos para preencher esse papel. Os químicos utilizam tampões para tomoderar rotineiramente o pH de uma reacção. A biologia encontra diversas utilizações para tampões que vão desde o controlo do pH do sangue até à detecção de que a urina não atinge níveis dolorosamente ácidos.
Um tampão é simplesmente uma mistura de um ácido fraco e a sua base conjugada ou uma base fraca e a sua base conjugada é ácido conjugado. Os tampões funcionam reagindo com qualquer orbase ácida adicionada para controlar o pH. Forexample, consideremos a acção de um tampão composto pela base fraca, NH3, e o seu ácido conjugado, NH4+. Quando HCl é adicionado a esse tampão, o NH3 “embebe” o próton do ácido para se tornar NH4+. Como esse protão está preso no ião de amónio, o protão não serve para aumentar significativamente o pH da solução. Quando NaOH é adicionado ao mesmo tampão, o ião de amónio doa um protão à base para se tornaramónia e água. Aqui o tampão também serve para neutralizar a base.
Como mostra o exemplo acima, um tampão funciona substituindo um ácido forte ou com uma base fraca. O próton do ácido forte é substituído por um ião de amónio, um ácido fraco. A base de Thestrong OH- foi substituída pela base fraca de amoníaco. Estas substituições de ácidos fortes e bases para os mais fracos dão aos tampões a sua extraordinária capacidade de moderar o pH.
Calcular o pH de soluções tampão
Buffers devem ser escolhidos para a gama de pH apropriada que são chamados a controlar. A gama de pH de uma solução tampão é dada pela equação de Henderson-Hasselbalch. Para o propósito da derivação, imaginaremos um tampão composto por um ácido, HA, e a sua base conjugada,A-. Sabendo que a constante de dissociação ácida pKa do ácido é dada por esta expressão:

A equação pode ser reordenada da seguinte forma:
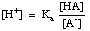
Tomando o -log desta expressão e rearranjando os termos para tornar cada um positivo dá a equação deHenderson-Hasselbalch: