Abstrait
Contexte
Le diagnostic de l’infarctus aigu du myocarde (IAM) est actuellement confirmé par la détermination de la troponine I (pTi) plasmatique. Sur la base des rapports précédents, selon lesquels les plaquettes des sujets IAM agrégées par différents agents agrégateurs ne pouvaient pas être inhibées par l’acide acétyl salicylique (aspirine), la faisabilité du diagnostic de l’IAM a été étudiée.
Méthodes
Des sujets âgés de 40 à 60 ans présentant soit un IAM (n=50, M=35, F=15) soit un SCA (n=30, M=20, F=10) et un nombre égal de volontaires normaux appariés par l’âge et le sexe ont participé à l’étude. L’inhibition par l’aspirine 80 µM de l’agrégation plaquettaire induite par 2,0 µM d’ADP a été étudiée en incubant le plasma riche en plaquettes (PRP) avec le composé pendant 30 min à 37°C et l’agrégation a été réalisée dans un agrégomètre optique.
Résultats
Alors que dans le cas du PRP normal, l’inhibition induite par l’aspirine était ≈100%. Dans le cas de SCA, le pourcentage d’inhibition était de 63,2 % par rapport aux cas d’IAM où aucune inhibition (c’est-à-dire 0 % d’inhibition, p<0,001) par l’aspirine dans l’agrégation plaquettaire induite par l’ADP a été trouvée (sensibilité= 92 % et spécificité = 100 %).
Conclusion
Il était possible de diagnostiquer la survenue d’un IAM par l’absence de l’effet inhibiteur de l’aspirine sur l’agrégation plaquettaire.
Mots clés
Agrégation plaquettaire, diagnostic d’infarctus du myocarde, troponine, aspirine.
Introduction
L’agrégation des plaquettes par différents agents d’agrégation plaquettaire, notamment l’ADP, la l-épinéphrine, le collagène ou la thrombine, est connue pour être essentielle au processus salvateur de la coagulation sanguine . D’autre part, une agrégation plaquettaire excessive sur le site de rupture de la plaque d’athérome sur la paroi de l’artère coronaire entraînerait le développement d’un thrombus, un micro-agrégat de plaquettes, qui peut parfois entraîner le blocage de la circulation sanguine normale dans la musculature du cœur et, par conséquent, le syndrome coronarien aigu (SCA). Bien que l’agrégation des plaquettes sur le site de rupture de la plaque artérielle puisse se transformer en SCA, l’agrégation des plaquettes peut aussi parfois bloquer l’artère péricardique, ce qui peut entraîner la mort des cellules cardiaques, qui apparaissent sous la forme de zones d’infarctus sombres dues à la mort des cellules cardiaques et qui peuvent finalement conduire à un infarctus aigu du myocarde (IAM) qui, lorsqu’il est massif, peut entraîner la mort des victimes. Les infarctus transmuraux dépendent de l’étendue des lésions du myocarde, qui peuvent ou non se manifester par une onde Q anormale, mais peuvent aussi être impliqués dans l’apparition d’ondes ST et T anormales dans 50 % des cas sur l’ECG, ce qui entraîne un infarctus du myocarde avec ou sans élévation du segment ST (STEMI). Bien que la douleur thoracique soit généralement intense et dure plus longtemps que dans le cas d’un SCA, la douleur elle-même est connue pour être subjective par nature et peut être un événement simulé autre que l’IAM lui-même. Et, en tant que tel, le diagnostic de l’IAM est généralement confirmé par la détermination de la troponine I (pTi) plasmatique par Enzyme Linked Immuno sorbent Assay (ELISA) en utilisant l’anticorps de la troponine I.
Cependant, la troponine I (Ti) et son anticorps sont tous deux coûteux et, en outre, l’ELISA lui-même peut ne pas toujours être suffisamment rapide pour confirmer la survenue d’un IAM dans une situation exigeante, ce qui peut être nécessaire pour l’éventuelle intervention thérapeutique pour cette condition. Pour ces raisons, le diagnostic de laboratoire de l’IAM n’est pas disponible, pas nécessairement par choix, dans de nombreuses régions du monde.
Nous avons récemment rapporté que le plasma riche en plaquettes (PRP) de patients atteints d’IAM pré-incubé avec 80 µM d’acide acétyl salicylique (aspirine), pendant 30 min à 37°C n’a pas réussi à inhiber l’agrégation des plaquettes initiée par différents agents d’agrégation plaquettaire, y compris l’ADP, par rapport à celle du PRP normal ou du PRP provenant de SCA. Sur la base de ces études préliminaires, nous avons étudié la possibilité de confirmer la survenue d’un IAM par agrégométrie optique même en l’absence de la détermination du pTi.
Nous rapportons ici la faisabilité de confirmer la survenue d’un IAM différencié de la survenue d’un SCA en déterminant l’inhibition de l’agrégation plaquettaire induite par l’ADP par l’intermédiaire d’un agrégomètre. La survenue d’un IAM a été confirmée par la détermination parallèle et simultanée de la pTi par ELISA.
Méthodes et matériels
Autorisation éthique
Le projet de recherche, »Diagnostic en laboratoire de l’infarctus aigu du myocarde par agrégométrie optique des plaquettes » a nécessité une quantité nominale de sang (2 ml) provenant des patients atteints d’IAM ou de SCA et des volontaires normaux. L’Institutional Review Board, Human & Animal Research Ethics Committee, Sinha Institute Of Medical Science And Technology, Kolkata, India a approuvé l’étude à condition de suivre le protocole d’éthique humaine approuvé strictement en accord avec la déclaration d’Helsinki de 1964 et aucune déviation de l’étude n’a été autorisée sans la permission écrite préalable du conseil. Tous les participants étaient âgés de 40 à 60 ans. Aucun retardé mental, aucune femme enceinte ni aucun prisonnier n’a participé à l’étude. Tous les volontaires ont signé un formulaire de consentement éclairé avant de participer à l’étude. Dans le cas des sujets ayant subi un SCA ou un IAM, l’autorisation de participer à l’étude a également été obtenue auprès des proches du patient en signant une déclaration sous serment. Les médecins traitants ont décidé si l’échantillon de sang (2 ml) pouvait être prélevé sur le patient sans mettre le sujet en danger. Le sang a été prélevé par le médecin traitant ou par une infirmière diplômée. Il a été vérifié que les volontaires ne souffraient d’aucune autre infection susceptible de mettre leur vie en danger. Le comité a inspecté régulièrement le déroulement et les problèmes de l’enquête en cours.
Chemiques
L’immunoglobuline G de chèvre anti-lapin, la phosphatase alcaline et l’ADP ont été obtenus auprès de Sigma Aldrich. Les plaques maxisorp Enzyme Linked Immunosorbent Assay (ELISA) provenaient de Nunc, Rosaklide, Danemark. Troponine I, anticorps Troponine I, CK-MB, anticorps CK-MB ont été obtenus auprès d’Abcam. L’acide acétylsalicylique (aspirine) a été obtenu auprès de Medica Zydus Healthcare. Tous les autres produits chimiques utilisés étaient de qualité analytique.
Sélection des patients atteints d’IAM
Un nombre total de 50 patients (n=50, M=35, F=15, âgés de 40 à 60 ans avec des douleurs thoraciques qui ont duré >120h ont participé à l’étude. Ces sujets ont été admis dans l’unité de soins intensifs du Calcutta Medical College and Hospital. Les patients souffrant de diabète sucré ou d’une infection potentiellement mortelle n’ont pas été inclus dans l’étude. Comme la paricardite, l’embolie pulmonaire, les troubles aortiques et intestinaux sont connus pour stimuler les douleurs thoraciques dues à un IAM ou à un SCA, les patients présentant ces pathologies ont été soigneusement exclus de l’étude. Tous les participants qui ont été hospitalisés pour une quelconque affection au cours des six derniers mois ou les patients qui ont reçu de l’aspirine dans les deux semaines ont été exclus de l’étude.
Sélection des volontaires normaux
Un nombre égal de volontaires normaux appariés en âge et en sexe a également été inclus dans l’étude. Aucun des volontaires normaux ne souffrait de diabète sucré ou n’avait d’antécédents d’hypertension systémique à la présentation. Aucun des volontaires normaux ne souffrait d’une infection potentiellement mortelle ou n’avait été hospitalisé pour une quelconque affection au cours des six derniers mois. Aucune des femmes volontaires n’avait reçu de médicaments contraceptifs. Aucun des volontaires n’avait pris d’aspirine ou de médicaments cardiaques au cours des 4 dernières semaines.
Diagnostic de l’IAM
Tous les patients ayant subi un IAM ont été admis dans l’unité de soins cardiaques intensifs de l’hôpital avec la douleur thoracique caractéristique décrite ci-dessus. Les patients IAM avec STEMI et non-STEMI ont été inclus dans l’étude. Tous les patients sélectionnés présentaient des ondes Q en développement sur l’ECG. Les cas où l’apparition d’ondes Q sur l’ECG ne pouvait être clairement démontrée ont été exclus de l’étude. La survenue d’un IAM a été confirmée par les taux de pTi par ELISA.
Diagnostic du SCA
Dans le cadre de l’étude prévue, 30 patients (n=30, M=20, F=20) âgés de 40 à 60 ans ont été inclus dans l’étude. Ces patients présentaient une douleur thoracique caractéristique. Les patients qui présentaient un bloc de branche et les régions d’ischémie cardiaque n’ont pas pu être déterminées par l’ECG ont été exclus de l’étude.
La survenue d’un SCA a été confirmée par la détermination de la CK-MB dans l’échantillon de sang en prélevant l’échantillon dans les 6h de l’admission à l’hôpital.
Les échantillons de sang soit dans le cas d’un IAM ou d’un SCA ont été obtenus des sujets avant l’initiation de toute thérapie cardiaque pour minimiser l’ambiguïté.
Protocole de l’étude
Les patients sélectionnés ont été randomisés et un numéro arbitraire a été attribué à chaque échantillon de sang provenant d’un IAM, d’un SCA et de volontaires normaux et conservé sous la supervision d’un personnel de bureau qui n’était pas un investigateur. L’investigateur ne savait pas si les échantillons sanguins prélevés provenaient d’un IAM, d’un SCA ou d’un volontaire normal. Ce n’est qu’après l’achèvement de l’étude que la « clé » des informations concernant l’état du participant était à la disposition des investigateurs pour les analyses statistiques. Tous les échantillons de sang ont été étudiés dès que possible après le prélèvement de l’échantillon.
Préparation du plasma riche en plaquettes (PRP)
Le PRP des sujets a été préparé par centrifugation comme décrit précédemment.
Le plasma libre de plaquettes (PFP) utilisé pour la détermination de la CK-MB ou de la pTi a été préparé par centrifugation des échantillons de sang à 10 000 g à 0°C .
Inhibition de l’agrégation plaquettaire par l’aspirine
Typiquement, le PRP des sujets présentant un IAM, un SCA ou des volontaires normaux a été incubé avec 80 µM d’aspirine pendant 30 min à 37°C. L’agrégation des plaquettes a été initiée en traitant le PRP avec 2 µM d’ADP pré-incubé avec ou sans aspirine. Dans les expériences de contrôle, le PRP a été traité avec un volume égal de NaCl 0,9% incubé à 37°C pendant 30 min.
Préparation de la solution d’aspirine
Une solution d’aspirine fraîchement préparée a été réalisée en dissolvant l’aspirine dans de l’eau dé-ionisée et le pH a été maintenu à 7,0 en ajoutant du NaHCO3 0,1M. La solution d’aspirine a été jetée après utilisation.
Dosage de la Troponine I et de la CK-MB plasmatiques
Les taux de pTi et de CK-MB ont été déterminés par ELISA en utilisant l’anticorps Troponine I et l’anticorps CK-MB.
Analyse statistique
Les résultats obtenus sont présentés sous forme d’écart-type +/-, tandis que la significativité des résultats a été déterminée en utilisant le test t de Student. Les valeurs de p<0,05 ont été considérées comme significatives. Le cas échéant, les coefficients de corrélation de Pearson ® des résultats ont également été déterminés. Le score de Pearson » r « , est tel que -1 ≤ r ≤ +1 est acceptable où les signes (+) et (-) sont désignés respectivement comme des corrélations linéaires positives et des corrélations linéaires négatives. Les logiciels Graph Pad Prism (Graph Pad Software, San Diego, et USA) et Micro Cal origin 6.0 ont été utilisés pour les analyses statistiques. L’évaluation des tests de diagnostic et l’analyse de la Courbe Opérateur Récepteur (ROC) ont été réalisées à l’aide du logiciel statistique MedCalc, Belgique. Selon l’analyse ROC, un test avec une discrimination parfaite (pas de chevauchement dans deux distributions) a une courbe ROC qui passe par le coin supérieur gauche (100% sensibilité, 100% spécificité). Par conséquent, plus la courbe ROC est proche du coin supérieur gauche, plus la précision globale du test est élevée. On a quantifié l’aire sous la courbe (AUC) qui est une mesure de la capacité d’un paramètre à distinguer deux groupes de diagnostic (malade/normal).
Résultats
L’effet de l’aspirine sur l’inhibition de l’agrégation plaquettaire induite par l’ADP dans le PRP des sujets atteints de SCA, IAM et des volontaires normaux
Lorsque le PRP de ces sujets a été incubé avec 80 µM d’aspirine pendant 30 min à 37°C et que l’agrégation plaquettaire a été initiée en traitant le PRP avec 2.0µM d’ADP, on a constaté que seulement dans le cas du PRP des sujets ayant subi un IAM, le composé n’a pas réussi à inhiber (0% d’inhibition) l’agrégation plaquettaire. En revanche, dans le cas d’un SCA (pourcentage d’inhibition compris entre 52 % et 68 %) ou dans le cas d’un PRP normal, les plaquettes ont été inhibées à 100 % (figure 1, panneau A). L’analyse de la courbe opérateur récepteur (ROC) a montré une sensibilité de 92 % (intervalle de confiance (IC) de 95 % : 91,0-100,0) et une spécificité de 100 % (IC de 95 % : 91,0-100,0, P<0,0001). L’aire sous la courbe (AUC) testée par l’analyse ROC s’est avérée égale à 0,952 (figure 1, panneau B).
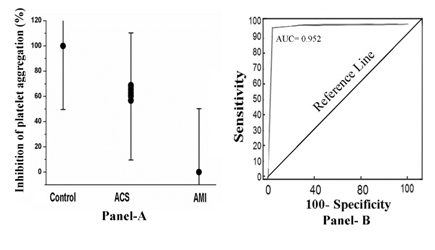
Figure 1. Le pourcentage d’inhibition de l’agrégation plaquettaire et l’analyse de la courbe opérateur récepteur dans le PRP par l’aspirine dans le cas de sujets normaux, SCA et IAM. Panneau A : Le PRP de sujets normaux, SCA et IAM a été préparé comme décrit dans les Matériaux et Méthodes et incubé avec 80 µM d’aspirine pendant 30 min à 37°C. Après incubation, l’agrégation plaquettaire a été initiée en ajoutant 2 µM d’ADP et étudiée dans un agrégomètre optique. Panneau B : Analyse de la courbe ROC de l’inhibition de l’agrégation plaquettaire dans laquelle la sensibilité est tracée en fonction de la spécificité pour différents points de coupure. Chaque point de la courbe ROC représente une paire sensibilité/spécificité correspondant à un seuil de décision particulier, comme décrit dans Méthodes et matériaux.
Relation entre le pTi et l’inhibition induite par l’aspirine de l’agrégation plaquettaire par l’ADP dans l’IAM, le SCA et dans le PRP normal.
Comme le montre la (figure 2, panneau A), l’augmentation du pTi s’est avérée inversement liée à l’ampleur de l’inhibition de l’agrégation plaquettaire induite par l’aspirine. En d’autres termes, l’augmentation de pTi qui était maximale dans le cas de l’IAM a également conduit au développement d’une résistance maximale des plaquettes à l’effet inhibiteur de l’aspirine (coefficient de corrélation, r de Pearson = -0,967, avec p<0.001), et l’inhibition de l’agrégation plaquettaire induite par l’aspirine était liée au maximum à l’absence totale de pTi dans le plasma normal et le niveau de pTi dans le SCA était supérieur à celui du plasma normal, ce qui a démontré que la troponine I était également présente dans le plasma du SCA, bien que moins que dans l’IAM. La courbe opérateur récepteur (analyse ROC) a montré une sensibilité de 85 % (intervalle de confiance (IC) de 95 % : 81,0-92,0) et une spécificité de 78 % (IC de 95 % : 75,0-80,0, P<0,0001). L’aire sous la courbe (AUC) testée par l’analyse ROC s’est avérée égale à 0,739 (figure 2, panneau B).
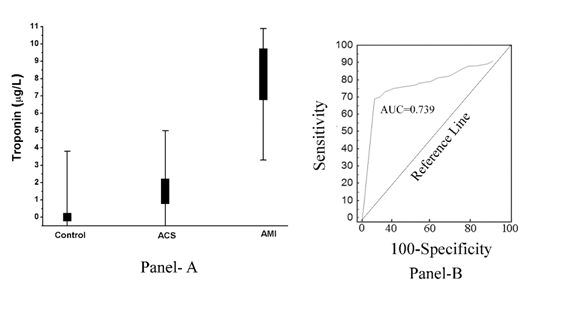
Figure 2. Taux de troponine I plasmatique chez les sujets normaux, SCA et IAM et son analyse ROC. Panneau A : Le niveau de pTi a été déterminé par ELISA en utilisant l’anticorps Troponin I comme décrit dans les matériaux et méthodes. Chaque point est en fait une superposition de 50 sujets normaux, 30 patients souffrant de SCA et 50 patients souffrant d’IAM. Panneau B : l’analyse de la courbe ROC des niveaux de pTi chez les patients normaux (non malades), IAM (malades) a été construite à l’aide de MedCalc comme décrit dans les Méthodes et Matériaux.
Discussion
L’infarctus aigu du myocarde, signalé comme étant causé par une thrombose qui entraîne la mort des cellules cardiaques pourrait sans doute être le trouble thrombotique le plus dangereux qui entraîne un grand nombre de décès parmi les victimes . Contrairement au SCA, dont la récurrence est prévenue par l’aspirine grâce à l’inhibition de l’agrégation excessive des plaquettes, les plaquettes de l’IAM résisteraient à l’effet inhibiteur du composé en raison de l’apparition de l’isoforme 2 de la dermcidine (DCN-2) dans la circulation. Malheureusement, en raison de l’absence d’inhibition de l’agrégation plaquettaire induite par l’aspirine, la plupart des premières victimes ont connu une récidive de l’IAM dans les mois qui ont suivi et ont succombé à cette maladie. Le DCN-2 s’est révélé être un puissant inhibiteur de la synthèse d’oxyde nitrique (NO) induite par l’aspirine. Il a été récemment rapporté qu’en éliminant le DCN-2 lié de la surface des plaquettes par une augmentation de la synthèse de NO dans les plaquettes, il est possible de resensibiliser les plaquettes de l’IAM à l’effet de l’aspirine .
Non seulement le traitement et la prévention de l’IAM par une intervention thérapeutique appropriée restent problématiques, mais même le diagnostic de laboratoire de la condition, différenciée de la survenue d’un SCA, reste prohibitif pour de nombreux laboratoires dans le monde qui est généralement nécessaire pour la confirmation de l’IAM par le niveau de pTi. Cela est dû au fait que la troponine I et son anticorps sont non seulement coûteux, mais que le test lui-même par ELISA nécessite un équipement spécial ainsi que les produits chimiques et les fournitures nécessaires, ce qui peut prendre beaucoup de temps dans une situation où la présence rapide et confirmée d’un IAM est essentielle pour l’intervention thérapeutique. En outre, l’interaction entre un antigène et son anticorps ne suit pas la stœchiométrie chimique bien connue et, de ce fait, le test lui-même peut poser des problèmes de validité de l’interprétation des données. De plus, le diagnostic du SCA, différencié de celui de l’IAM, par la détermination de la CK-MB plasmatique par elle-même est une procédure coûteuse.
Les résultats présentés ci-dessus ont fortement suggéré la faisabilité du diagnostic de l’IAM, différencié de la survenue du SCA, par une simple agrégométrie plaquettaire à l’aide d’un agrégomètre de laboratoire ordinaire en une heure (Sensibilité= 92% et Spécificité= 100% comme déterminé par l’analyse ROC). La courbe du test de diagnostic, telle que décrite dans les matériaux et méthodes, passe près du coin supérieur gauche (Figure 1, panneau B), ce qui implique une précision proche de 100 % du test de diagnostic par rapport au pTi (Figure 2, panneau B).
De plus, comme l’agrégation des plaquettes dans le PRP ne peut pas être inhibée par l’aspirine dans l’IAM, mais que les plaquettes du PRP des sujets atteints de SCA pourraient l’être, le diagnostic de l’IAM par agrégométrie plaquettaire pourrait être un événement économique ainsi que « tout ou rien », c’est-à-dire.En d’autres termes, l’agrégation des plaquettes de l’IAM pourrait ou ne pourrait pas être obtenue du tout par le traitement du PRP avec de l’aspirine, alors que l’agrégation des plaquettes des patients atteints de SCA pourrait être inhibée de façon marquée par le même composé (Figure 1). Cependant, il a été constaté que même les plaquettes provenant de patients atteints de SCA étaient un peu plus résistantes à l’effet inhibiteur de l’aspirine que dans le cas de plaquettes normales. D’autre part, les plaquettes provenant de l’IAM étaient maximalement résistantes à l’effet de l’aspirine qui était inversement lié aux niveaux de pTi (le coefficient de corrélation (r) entre le niveau de pTi et le % d’inhibition par l’aspirine était -0.967, p<0,001).
Il convient de mentionner dans le contexte ci-dessus qu’un diagnostic rapide et de confirmation de l’IAM est nécessaire pour l’utilisation de la thérapie thrombolytique qui peut réduire le taux de mortalité dans l’IAM de 30 à 50 % . Il convient également de noter qu’environ 50 % des patients présentant une augmentation de la pTi ne présentent ni élévation du segment ST ni ondes Q à l’ECG et, à ce titre, le diagnostic agrégométrique plaquettaire de l’IAM pourrait être une méthode encore plus utile sur le plan diagnostique que l’ECG, tout en étant beaucoup moins coûteuse que l’ELISA pour la détermination de la pTi.
La quantification de la pTi dans la circulation des patients atteints d’IAM est généralement effectuée en tant que protéine marqueur de confirmation de l’IAM. Cependant, dans une étude préliminaire, il a été constaté que la pTi était également un inhibiteur de la synthèse du NO et un puissant inducteur de l’agrégation plaquettaire dans des gammes (nM) similaires aux niveaux de pTi dans le plasma de l’IAM (non publié). Cependant, comme le niveau plasmatique de troponine I dans le SCA était supérieur à celui du plasma normal, mais bien inférieur à celui de l’IAM, ces résultats suggèrent que l’augmentation de la pTi se produit également dans le SCA, mais presque 6 fois moins que dans l’IAM. Ces résultats suggéraient néanmoins que l’augmentation du pTi par rapport au plasma normal seul ne confirme pas nécessairement la survenue d’un IAM différencié de la survenue éventuelle d’un SCA.
Nous avons récemment rapporté que la douleur angineuse caractéristique de l’IAM était liée à la réduction sévère du taux de NO dans le plasma qui était due à l’inhibition de la synthèse du NO par le DCN-2 ou d’autres inhibiteurs systémiques de l’oxyde nitrique synthase . Comme le pTi s’est révélé être un nouvel agent d’agrégation plaquettaire (non publié), par l’inhibition de la NOS dans les plaquettes, il est possible que le pTi lui-même soit impliqué dans la douleur angineuse, du moins en partie, dans l’IAM. Le déversement de pTi dans la circulation à partir des muscles cardiaques pourrait être thrombogène en soi et contribuer au développement d’une résistance à l’effet inhibiteur de l’aspirine dans les plaquettes de l’IAM, similaire à l’effet du DCN- 2, entraînant l’initiation ou l’aggravation de la condition. Et donc, la présence de pTi pourrait elle-même avoir un rôle de mauvais augure dans le développement de la résistance à l’effet inhibiteur de l’aspirine dans les plaquettes de l’IAM conduisant à la récurrence de la condition.
- Colman RW, Walsh PN (1987) Haemostasis andthrombosis. In : Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphie, PA (USA), J.B. Lippincott : 594-605.
- Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Plaque rupture, thrombose, et implications thérapeutiques. Haemostasis 4 : 269-284.
- Page DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) Myocardial changes associated with cardiogenic shock. N Engl J Med 285 : 133-137.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inhibition de l’agrégation des plaquettes sanguines humaines et stimulation de la synthèse de l’oxyde nitrique par l’aspirine. Platelets 14 : 421-427.
- Zweig MH1, Campbell G (1993) Receiver-operating characteristic (ROC) plots : a fundamental evaluation tool in clinical medicine. Clin Chem 39 : 561-577.
- Bank S, Jana P, Maiti S, Guha S, Sinha AK (2014) L’isoforme-2 de la dermcidine induit la nullité de l’effet de l’acide acétyl salicylique dans l’agrégation plaquettaire dans l’infarctus aigu du myocarde. Sci Rep 4 : 5804.
- Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) L’apparition de la dermcidine isoforme 2, un nouvel agent d’agrégation plaquettaire dans la circulation dans l’infarctus aigu du myocarde qui inhibe la synthèse de l’insuline et la restauration par l’acide acétyl salicylique de ses effets. J Thromb Thrombolysis 31 : 13-21.
- Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. Investigateurs de l’étude TEAM-2. Circulation 90 : 94-100.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Réduction du taux de décès par infarctus aigu du myocarde chez les sujets atteints de cancers par la restauration systémique de l’oxyde nitrique altéré. PLoS One 9 : e88639.