US Pharm. 2017;42(12):HS2-HS6.
ABSTRACT : La diarrhée est souvent le symptôme révélateur chez les patients souffrant du syndrome carcinoïde secondaire à une tumeur carcinoïde. L’étiologie de cette diarrhée pesante serait une hypersécrétion de sérotonine par les cellules neuroendocrines. Le diagnostic est établi sur la base des symptômes cliniques et de deux biomarqueurs, l’acide 5-hydroxyindoleacétique (présent dans l’urine) et la chromogranine A (présente dans le sérum). Les analogues synthétiques de la somatostatine (SSA) ont été un élément essentiel du traitement pendant des années et continuent d’être utilisés. Le télotristat est le premier médicament oral indiqué en association avec les SSA pour les patients souffrant de diarrhée liée au syndrome carcinoïde et ne répondant plus aux SSA seuls.
Les tumeurs neuroendocrines (TNE) englobent une grande variété de tumeurs à croissance lente. L’incidence aux États-Unis varie de deux à cinq pour 100 000 patients et semble augmenter, probablement en raison de l’amélioration des techniques de dépistage.1 Bien que ces tumeurs soient généralement asymptomatiques, les symptômes sont plus susceptibles de se développer lorsqu’une tumeur métastase au foie ou au poumon ou si la tumeur primaire provient de l’intestin moyen – c’est-à-dire , l’intestin grêle, l’appendice ou le gros intestin proximal.2,3
Tumeurs carcinoïdes et syndrome carcinoïde
Les tumeurs carcinoïdes sont des TNE qui proviennent principalement des cellules entérochromaffines situées dans l’ensemble des voies gastro-intestinales (GI) et bronchiques1,2. Ces cellules sont responsables de la production, du stockage et de la sécrétion de nombreuses substances biologiquement actives – dont la sérotonine, la noradrénaline, la dopamine, l’histamine, la bradykinine, les prostaglandines, la substance P et d’autres – qui peuvent conduire au développement du syndrome carcinoïde, un terme collectif englobant une variété de symptômes médiés par les hormones sécrétées par la tumeur carcinoïde1-4.
Une TNE bien différenciée exprime de nombreux récepteurs de la somatostatine (SSTR).1 Parmi les cinq types de SSTR, les SSTR1 et SSTR5 sont ciblés par les analogues synthétiques de la somatostatine (SSA). Les tumeurs carcinoïdes excrètent trop de sérotonine, ce qui épuise le tryptophane endogène. Une cellule normale ne convertit que 1 % du tryptophane en sérotonine, alors qu’une cellule de tumeur carcinoïde produit de la sérotonine jusqu’à épuisement des réserves de tryptophane3. Le tryptophane est un précurseur de la niacine, qui est un composant essentiel du nicotinamide et du phosphate de nicotinamide adénine dinucléotide/nicotinamide adénine dinucléotide, ainsi que de la synthèse des protéines.3
Les symptômes les plus courants du syndrome carcinoïde sont les bouffées vasomotrices, la diarrhée, la tachycardie, le bronchospasme et l’essoufflement. Une instabilité hémodynamique peut également se produire, bien que cela soit rare avec les thérapies actuelles.5 Les patients atteints d’un syndrome carcinoïde non contrôlé à long terme peuvent développer une pellagre, des lésions valvulaires cardiaques, une télangiectasie veineuse et/ou un bronchospasme.2 Moins de 10 % des patients atteints de tumeurs carcinoïdes gastro-intestinales développent un syndrome carcinoïde, et la plupart de ceux qui le font ont des métastases hépatiques2.
Diarrhée du syndrome carcinoïde
La diarrhée survient chez 80 % des patients atteints du syndrome carcinoïde.6 Les patients atteints de diarrhée du syndrome carcinoïde présentent des selles explosives, aqueuses et molles plusieurs fois par jour, ce qui peut être pénible pour le patient et difficile pour le prestataire de soins. Une étude de cohorte a révélé que les coûts des soins de santé sont 1,5 fois plus élevés et que le risque d’hospitalisation est deux fois plus élevé chez les patients souffrant de diarrhée liée au syndrome carcinoïde que chez ceux qui n’ont pas de diarrhée.7 La pathophysiologie de la diarrhée liée au syndrome carcinoïde implique la présence d’un excès de sérotonine, qui stimule la sécrétion de mucus colique, augmente le péristaltisme et inhibe l’absorption dans le tube digestif, ce qui entraîne la diarrhée.3,4,6 Par rapport aux patients en bonne santé, le temps de transit du côlon proximal peut être jusqu’à six fois plus rapide et le temps de transit de l’intestin grêle peut être deux fois plus rapide chez les patients souffrant de diarrhée liée au syndrome carcinoïde.6
Facteurs de risque
On pense que les TNE se développent de manière sporadique ou chez les personnes génétiquement prédisposées.3 Lorsqu’un parent au premier degré est atteint d’une TNE, le risque de développer une TNE est de 12,5 pour 100 000 personnes et de 15,7 pour 100 000 personnes chez les hommes et les femmes, respectivement7. D’autres conditions associées, qui ont été rapportées dans une étude rétrospective de 36 patients souffrant de diarrhée liée au syndrome carcinoïde, comprennent la gastrite atrophique (67%), l’anémie pernicieuse (58%), l’hypothyroïdie (39%), le diabète (19%), l’insuffisance corticosurrénale (6%) et l’hyperparathyroïdie (6%).8 Selon une enquête prospective portant sur 494 000 sujets inscrits à l’étude NIH-AARP Diet and Health Study et suivis pendant 8 ans, la consommation de graisses saturées est associée à un risque accru de développer des tumeurs carcinoïdes.9 Les apports en viande et en graisses ont été estimés à partir de questionnaires sur la fréquence des repas. Le risque de tumeurs carcinoïdes de l’intestin grêle était associé à un apport élevé en graisses saturées par rapport à un apport faible en graisses saturées (rapport de risque de 3,18 ; IC à 95 %, 1,62-6,25).9 Lorsqu’un patient souffre de diarrhée liée au syndrome carcinoïde, le régime alimentaire et le stress peuvent avoir un impact sur les symptômes. Les patients doivent éviter les facteurs précipitants tels que les aliments contenant de la tyrosine (fromage vieilli, viande et poisson fermentés, aliments marinés, tofu, chocolat), l’alcool et l’augmentation des catécholamines (exercice, effort).1,2
Diagnostic
Le diagnostic de diarrhée du syndrome carcinoïde repose sur les symptômes de diarrhée et de bouffées vasomotrices associés à des constatations objectives de tumeur carcinoïde par biopsie, tomodensitométrie abdominale/pelvienne multiphasique, IRM ou biomarqueurs10. Les biomarqueurs acide 5-hydroxyindolacétique (5-HIAA ; présent dans l’urine) et chromogranine A (CgA ; présent dans le sérum) ont une spécificité et une sensibilité acceptables pour les tumeurs carcinoïdes.10,11 La sérotonine est métabolisée par la monoamine oxydase en 5-HIAA, et la CgA est libérée des parois des vésicules qui stockent la sérotonine. Les taux urinaires normaux de 5-HIAA varient de 3 à 15 mg/24 h ; un taux élevé a une spécificité de 100 % et une sensibilité de 73 % pour les tumeurs carcinoïdes.11 Les taux sériques de CgA ont tendance à être corrélés avec le volume de la tumeur, mais pas avec les symptômes. Des taux de CgA supérieurs à 130 mcg/L sont associés à une spécificité de 98,4 % et à une sensibilité de 62,9 % pour les tumeurs carcinoïdes.11 Les patients doivent éviter les aliments riches en sérotonine 48 heures avant la collecte d’urine. Les taux urinaires de 5-HIAA peuvent être faussement abaissés par la lévodopa, tandis que les taux sériques de CgA peuvent être faussement élevés par les inhibiteurs de la pompe à protons, l’insuffisance rénale ou les états inflammatoires10-13.
Traitement
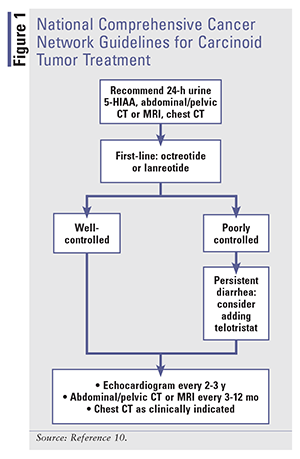
Les modalités de traitement de la diarrhée liée au syndrome carcinoïde se concentrent sur l’amélioration des symptômes et la modification de la maladie elle-même, comme en témoigne la normalisation des biomarqueurs.11 Les SSA constituent le pilier du traitement des tumeurs carcinoïdes. La somatostatine influence plusieurs fonctions gastro-intestinales, y compris la motilité gastro-intestinale, la sécrétion d’hormones pancréatiques et intestinales, et la sécrétion de bile et de liquides coliques.13 Lorsqu’elle se lie aux récepteurs, la somatostatine inhibe la sécrétion de médiateurs biologiques, ce qui améliore considérablement les bouffées vasomotrices et la diarrhée en diminuant la sérotonine, comme le montrent les réductions de 5-HIAA dans l’urine.13 Une régression tumorale est également observée avec les SSA.12,14,15 Voir la FIGURE 1 pour les directives du National Comprehensive Cancer Network (NCCN) pour le traitement des tumeurs carcinoïdes.
Analogues de la somatostatine : Les SSAs octréotide et lanréotide fournissent un contrôle hormonal chez les patients atteints de tumeurs carcinoïdes.16,17 L’octréotide à courte durée d’action (SA) a été le premier SSA approuvé pour le contrôle des symptômes associés aux tumeurs carcinoïdes.16,18 Malheureusement, avec une demi-vie de 2 heures, des doses répétées sont nécessaires. L’octréotide à libération prolongée (LA) fournit des niveaux de médicament soutenus et est administré par voie IM mensuellement.15 Les études comparant les formulations SA et LA ont démontré une efficacité similaire en termes de contrôle des symptômes, avec des taux de réponse de 60 % à 72 %.18
Le lanréotide est disponible sous forme de formulation à libération prolongée (Somatuline Depot) administrée par injection SC profonde toutes les 4 semaines.17,18 L’octréotide SA et le lanréotide LA ont une efficacité similaire pour le soulagement des symptômes.16 Un essai clinique de phase III a été mené pour évaluer l’utilisation de l’octréotide SA SC pour contrôler les symptômes associés au syndrome carcinoïde chez des patients recevant du lanréotide 120 mg SC (n = 59) ou un placebo (n = 56) toutes les 4 semaines pendant 16 semaines19. Le pourcentage de jours où l’octréotide était utilisé comme médicament de secours était significativement plus faible chez les patients traités par lanréotide (33,7 % ; IC à 95 %, 25 %-42,4 %) que chez les patients sous placebo (48,5 % ; IC à 95 %, 39,6 %-57,4 %, P = 0,016).
Le pasiréotide (Signifor) se lie à SSTR1 et SSTR5 avec une affinité plus élevée que l’octréotide et le lanréotide16. Dans un essai clinique de phase II, il a démontré son efficacité chez les patients atteints de TNE avancées et de syndrome carcinoïde qui ne répondaient plus à l’octréotide.20 Le pasiréotide à libération prolongée (LAR), qui n’est approuvé par la FDA que pour l’acromégalie et le syndrome de Cushing, a montré une efficacité similaire dans le contrôle des symptômes du syndrome carcinoïde par rapport à l’octréotide LAR à haute dose et a entraîné une amélioration de la survie sans progression chez les patients réfractaires aux SA dans une étude de phase III de 2015.21,22
Lorsque le contrôle des symptômes est l’objectif, le traitement commence avec l’octréotide SA. Étant donné qu’il faut parfois jusqu’à 3 semaines pour que les préparations de LA atteignent des niveaux d’équilibre, le contrôle des symptômes peut être pris en charge avec l’octréotide SA.15,18 La posologie est initiée à faible dose (100-600 mcg par jour en 2-4 doses) et est ajustée jusqu’à la dose efficace la plus faible nécessaire pour contrôler les symptômes. L’octréotide LA commence à 20 mg IM par voie intragluteuse toutes les 4 semaines, l’octréotide SA étant administré en même temps pendant au moins 2 semaines. Voir le TABLEAU 1 pour la posologie, les effets indésirables et les interactions médicamenteuses potentielles.
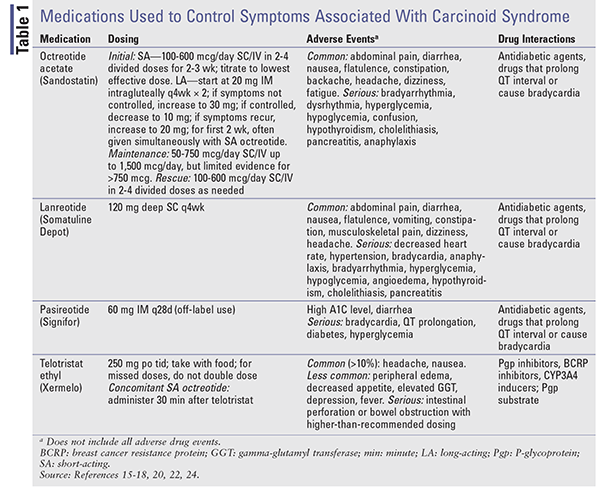
Télotristat Ethyl : Le télotristat éthyle (Xermelo), qui est un promédicament du télotristat, inhibe l’enzyme tryptophane hydroxylase, ce qui entraîne une diminution de la sérotonine périphérique. Il est approuvé par la FDA pour le traitement de la diarrhée liée au syndrome carcinoïde en association avec le traitement par SSA chez les patients insuffisamment contrôlés par le traitement par SSA seul23,24. Une étude prospective et randomisée de phase III a été menée dans laquelle 135 patients ayant quatre selles ou plus par jour malgré un traitement par AAS à dose stable ont reçu du telotristat 250 mg trois fois par jour, du telotristat 500 mg trois fois par jour ou un placebo pendant 12 semaines.25 Les réductions moyennes de la fréquence des selles par jour pour le placebo, le telotristat 250 mg et le telotristat 500 mg étaient respectivement de -0,9, -1,7 et -2,1. Le telotristat est coûteux, avec un prix de gros moyen de 6 196,80 $ pour quatre-vingt-quatre comprimés de 250 mg.23
Autres agents : La diarrhée liée au syndrome carcinoïde est traitée par les ASA, et le telotristat est ajouté lorsque les symptômes restent incontrôlés. Une réponse positive aux agents chimiothérapeutiques qui traitent la NET sous-jacente, réduisant ainsi l’activité tumorale, peut soulager les symptômes du syndrome carcinoïde. L’examen de ces agents chimiothérapeutiques dépasse le cadre de cet article. Si la maladie progresse après l’utilisation de l’octréotide ou du lanréotide, le NCCN recommande l’utilisation de l’évérolimus ; de l’interféron alfa-2b ; ou des agents chimiothérapeutiques cytotoxiques 5-fluorouracile, capécitabine, dacarbazine, oxaliplatine, streptozocine ou témozolomide pour les TNE non résécables et/ou métastatiques du tube digestif10.
Conclusion
L’incidence des tumeurs carcinoïdes, un type de TNE, est en augmentation. Il n’existe pas de facteurs de risque connus pour le développement des TNE ni de facteurs permettant d’identifier les patients qui développeront un syndrome carcinoïde, bien que la plupart des patients atteints de syndrome carcinoïde présentent souvent des métastases hépatiques au moment de leur apparition. Le syndrome carcinoïde décrit un groupe de symptômes médiés par diverses hormones libérées par une tumeur carcinoïde. Tous les patients atteints de tumeurs carcinoïdes ne présentent pas le syndrome carcinoïde. La diarrhée du syndrome carcinoïde peut être explosive et se produire plusieurs fois par jour. Les ASA sont le pilier du traitement pour le soulagement symptomatique de la diarrhée secondaire aux tumeurs carcinoïdes, et de nouvelles thérapies, comme le télotristat ajouté au traitement par ASA, offrent des options aux patients dont les symptômes sont insupportables.
1. Cives M, Soares HP, Strosberg J. L’hétérogénéité clinique des tumeurs neuroendocrines aura-t-elle un impact sur leur gestion à l’avenir ? Leçons tirées des essais récents. Curr Opin Oncol. 2016;28:359-366.
2. Robertson RG, Geiger WJ, Davis NB. Les tumeurs carcinoïdes. Am Fam Physician. 2006;74:429-434.
3. Lips CJ, Lentjes EG, Höppener JW. Le spectre des tumeurs carcinoïdes et des syndromes carcinoïdes. Ann Clin Biochem. 2003;40:612-627.
4. Bertrand PP, Bertrand RL. Libération et captation de la sérotonine dans le tractus gastro-intestinal. Auton Neurosci. 2010;153:47-57.
5. Yao JC, Hassan M, Phan A, et al. One hundred years after « carcinoid » : epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26:3063-3072.
6. von der Ohe MR, Camilleri M, Kvols LK, Thomforde GM. Dysfonctionnement moteur de l’intestin grêle et du côlon chez les patients atteints du syndrome carcinoïde et de diarrhée. N Engl J Med. 1993;329:1073-1078.
7. Babovic-Vuksanovic D, Constantinou CL, Rubin J, et al. Familial occurrence of carcinoid tumors and association with other malignant neoplasms. Cancer Epidemiol Biomarkers Prev. 1999;8:715-719.
8. Gough DB, Thompson GB, Crotty TB, et al. Diverse clinical and pathologic features of gastric carcinoid and the relevance of hypergastrinemia. World J Surg. 1994;18:473-479.
9. Cross A, Leitzmann MF, Subar AF, et al. Une étude prospective de la consommation de viande et de graisse en relation avec le cancer de l’intestin grêle. Cancer Res. 2008;68:9274-9279.
10. National Comprehensive Cancer Network. Directives de pratique clinique du NCCN en oncologie (NCCN guidelines®) : tumeurs neuroendocrines. Version 3.2017. www.nccn.org/professionals/physician_gls/PDF/neuroendocrine.pdf. Consulté le 11 octobre 2017.
11. Maroun J, Kocha W, Kvols L, et al. Lignes directrices pour le diagnostic et la gestion des tumeurs carcinoïdes. Partie 1 : le tractus gastro-intestinal. Une déclaration d’un groupe national canadien d’experts en carcinoïdes. Curr Oncol. 2006;13:67-76.
12. Eriksson B, Oberg K, Stridsberg M. Tumor markers in neuroendocrine tumors. Digestion. 2000;62(suppl 1):33-38.
13. van der Lely AJ, de Herder WW. Syndrome carcinoïde : diagnostic et prise en charge médicale. Arq Bras Endocrinol Metabol. 2005;49:850-860.
14. Cives M, Strosberg J. Stratégies de traitement des tumeurs neuroendocrines métastatiques du tractus gastro-intestinal. Curr Treat Options Oncol. 2017;18:14.
15. Enzler T, Fojo T. Les analogues de la somatostatine à longue durée d’action dans le traitement des tumeurs neuroendocrines non résécables/métastatiques. Semin Oncol. 2017;44:141-156.
16. Octréotide. Lexicomp Online. Hudson, OH : Lexi-Comp, Inc ; 2017. http://online.lexi.com. Consulté le 11 octobre 2017.
17. Lanréotide. Lexicomp Online. Hudson, OH : Lexi-Comp, Inc ; 2017. http://online.lexi.com. Consulté le 11 octobre 2017.
18. Narayanan S, Kunz PL. Rôle des analogues de la somatostatine dans le traitement des tumeurs neuroendocrines. Hematol Oncol Clin N Am. 2016;30:163-177.
19. Vinik AI, Wolin EM, Liyanage N, et al. Évaluation de l’efficacité et de la sécurité du lanréotide depot/autogel comme traitement du syndrome carcinoïde (ELECT) : un essai randomisé, en double aveugle, contrôlé par placebo. Endocr Pract. 2016;22:1068-1080.
20. Kvols LK, Oberg KE, O’Dorisio TM, et al. Pasireotide (SOM230) montre une efficacité et une tolérance dans le traitement des patients atteints de tumeurs neuroendocrines avancées réfractaires ou résistantes à l’octréotide LAR : résultats d’une étude de phase II. Endocr Relat Cancer. 2012;19:657-666.
21. Wolin EM, Jarzab B, Eriksson B, et al. Étude de phase III du pasiréotide à libération prolongée chez des patients atteints de tumeurs neuroendocrines métastatiques et de symptômes carcinoïdes réfractaires aux analogues de la somatostatine disponibles. Drug Des Devel Ther. 2015;9:5075-5086.
22. Pasireotide. Micromedex Solutions. Greenwood Village, CO : Truven Health Analytics. www.micromedexsolutions.com. Consulté le 23 octobre 2017.
23. Markham A. Télotristat éthyle : première approbation mondiale. Médicaments. 2017;77:793-798.
24. Telotristat. Lexicomp Online. Hudson, OH : Lexi-Comp, Inc ; 2017. http://online.lexi.com. Consulté le 11 octobre 2017.
25. Kulke MH, Hörsch D, Caplin ME, et al. Telotristat ethyl, un inhibiteur de la tryptophane hydroxylase pour le traitement du syndrome carcinoïde. J Clin Oncol. 2017;35:14-23.