La FDA et les CDC, en collaboration avec les partenaires étatiques et locaux, ont terminé l’enquête sur deux des trois éclosions multi-états d’infections à E. coli O157:H7 aux États-Unis cet automne.
L’une de ces enquêtes, Outbreak Unknown Source 3, a identifié 18 maladies signalées dans neuf États : Californie, Colorado, Illinois, Michigan, New York, Ohio, Pennsylvanie, Virginie, Washington.
La FDA a effectué une enquête de traçabilité de plusieurs véhicules alimentaires potentiels identifiés dans les entretiens avec les patients et, bien qu’aucune ferme n’ait été identifiée comme source commune de l’épidémie, la FDA et les partenaires étatiques ont également mené des enquêtes sur place dans les fermes d’intérêt. Cependant, les informations et les échantillons recueillis lors de ces inspections n’ont pas permis de relier ces fermes à l’épidémie. L’investigation d’une ferme ne signifie pas que cette dernière est liée à l’épidémie. Les résultats d’une enquête sur une ferme peuvent très bien conduire à écarter cette entreprise de l’enquête. Le 18/12/2020, le CDC a annoncé que cette épidémie était terminée.
L’autre enquête terminée sur l’épidémie, Outbreak Unknown Source 1, a identifié 32 maladies signalées dans 12 États : Californie, Illinois, Louisiane, Maryland, Michigan, Montana, New Jersey, Ohio, Utah, Virginie, Washington, Wisconsin. Cette souche d’E. coli est génétiquement similaire à une souche liée à une épidémie de romaine survenue au printemps 2018, bien qu’un aliment n’ait pas été lié à l’épidémie actuelle. La FDA a effectué une enquête de traçabilité et n’a pas été en mesure de déterminer une source commune de l’épidémie. La FDA et les partenaires étatiques ont également mené des inspections sur place dans des fermes d’intérêt, bien que les informations recueillies lors de ces inspections n’aient pas permis de relier ces fermes à l’épidémie. Le 18/12/2020, le CDC a annoncé que cette épidémie avait pris fin.
Les enquêtes sur une troisième épidémie d’E. coli de source inconnue 2 se poursuivent.
Recommandation
Les consommateurs, les restaurants et les détaillants, ont été avisés de ne pas consommer, vendre ou servir la laitue romaine monotête emballée de marque Tanimura & Antle, Inc. rappelée dont la date d’emballage est le 15/10/2020 ou le 16/10/2020.
Les produits rappelés ont maintenant largement dépassé leur date de péremption et ne sont probablement plus sur le marché ou chez les consommateurs.
Images des produits

Information sur le rappel
Le 6 novembre 2020, Tanimura & Antle, Inc. a rappelé de la laitue romaine à une seule tête sous la marque Tanimura & Antle, étiquetée avec une date d’emballage du 15/10/2020 ou du 16/10/2020, en raison d’une possible contamination par E. Coli O157:H7. Les paquets contiennent une seule tête de laitue romaine avec le numéro CUP 0-27918-20314-9.
Selon Tanimura & Antle, le produit potentiellement affecté a été distribué dans les États suivants : AK, OR, CA, TX, AR, OK, IN, NE, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR et IL, mais le produit aurait pu être distribué davantage, atteignant d’autres États, dont le MI.
Le produit a été expédié dans des caisses conditionnées en 12, 15, 18 ou 24 têtes par caisse. Les détaillants et les distributeurs peuvent identifier les produits potentiellement concernés grâce à l’autocollant Produce Traceability Initiative (PTI) fixé à l’extérieur de la caisse. Les codes PTI sont 571280289SRS1 et 571280290SRS1.
Carte de distribution aux États-Unis des produits rappelés de Tanimura & Antle, Inc. Laitue romaine simple tête
Distribution des produits* : AK, OR, CA, TX, AR, OK, IN, NE, MI, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR, IL
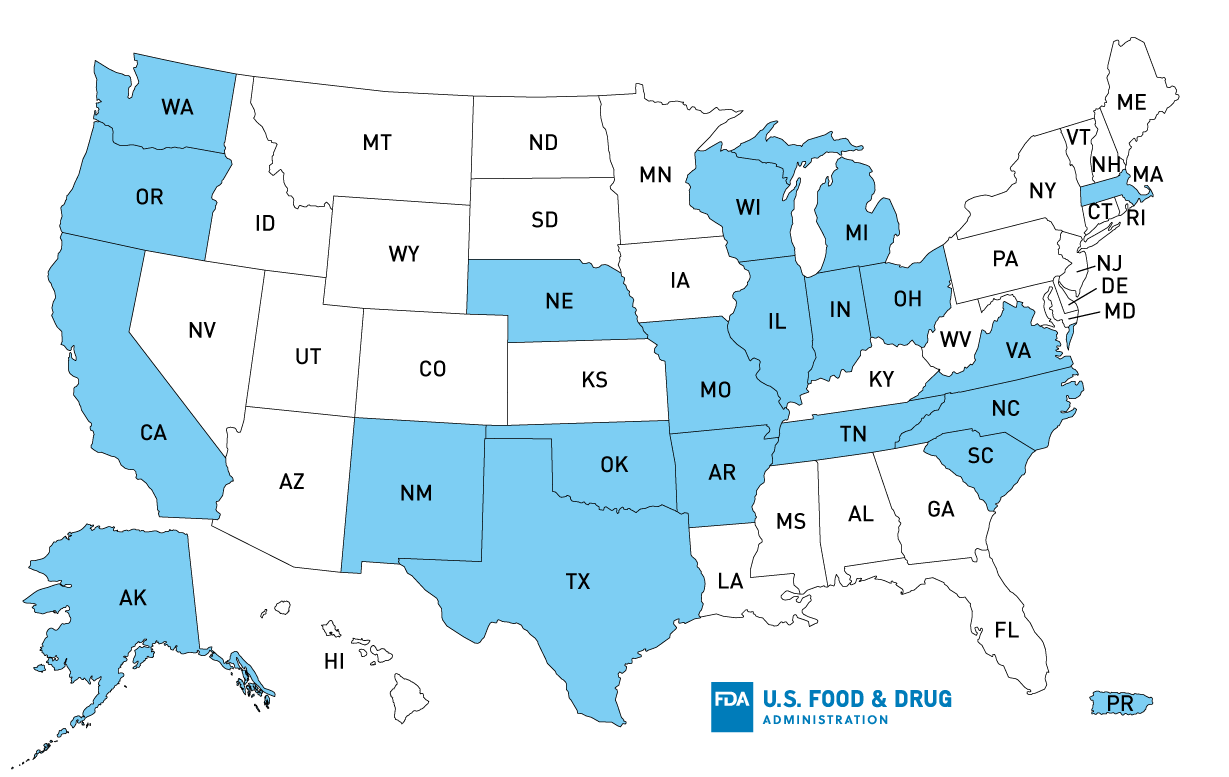
*États dont la distribution a été confirmée ; le produit aurait pu être distribué plus loin
Dénombrement des cas
Pour ces éclosions, le dénombrement des cas se trouve sur le site Web du CDC :
- Page des éclosions du CDC : Source inconnue 1
- Page des épidémies du CDC : Source inconnue 2
- Page d’épidémie du CDC : Source inconnue 3
Mises à jour précédentes
12 novembre 2020
La FDA et le CDC, en collaboration avec les partenaires étatiques et locaux, enquêtent sur des maladies dans une troisième épidémie multi-états d’E.coli O157:H7 cet automne.
Le 6 novembre 2020, le Michigan Department of Agriculture and Rural Development (MDARD) a signalé que dans le cadre d’un échantillonnage de routine, ils ont recueilli un échantillon de produit de laitue romaine pour le tester. L’échantillon a été testé positif pour E. coli O157:H7 et une analyse subséquente de séquençage du génome entier (WGS) a déterminé que l’E. coli O157:H7 présent dans les échantillons correspond à la souche qui a causé des maladies dans cette épidémie.
La souche d’E. coli trouvée dans l’échantillon du Michigan est une troisième souche distincte qui n’est pas génétiquement liée aux souches à l’origine de deux épidémies multi-états distinctes d’E. coli O157:H7 producteur de Shiga-toxine (STEC) que la FDA et les CDC ont annoncées le 28 octobre 2020. À l’heure actuelle, un aliment spécifique n’a pas été lié à l’une ou l’autre de ces éclosions.
Le 6 novembre 2020, Tanimura & Antle, Inc. a rappelé de la laitue romaine monotête emballée dont la date d’emballage était le 15/10/2020 ou le 16/10/2020 en raison d’une possible contamination par E. coli O157:H7. La firme a rappelé ce produit sur la base des résultats d’analyse d’un échantillon de produit collecté et analysé par le MDARD avant que l’analyse WGS montrant la correspondance avec la souche de l’épidémie ne soit terminée.
La FDA et les partenaires de l’État travaillent avec la firme pour déterminer si d’autres romaines doivent être rappelées.
À l’heure actuelle, il n’y a pas suffisamment de preuves épidémiologiques et de traçabilité pour déterminer si les personnes malades dans cette épidémie ont été exposées à la laitue romaine de Tanimura & Antle, Inc. Des informations supplémentaires seront fournies dès qu’elles seront disponibles.
Qui contacter
Les consommateurs qui présentent des symptômes doivent contacter leur fournisseur de soins de santé pour signaler leurs symptômes et recevoir des soins.
Pour signaler une plainte ou un événement indésirable (maladie ou réaction allergique grave), vous pouvez
- Appeler un coordinateur des plaintes des consommateurs de la FDA si vous souhaitez parler directement à une personne de votre problème.
- Compléter un formulaire électronique de MedWatch volontaire en ligne.
- Compléter un formulaire papier de MedWatch volontaire qui peut être envoyé par courrier à la FDA.
.