- Contexte
- Etiologie
- Epidémiologie
La carence combinée en facteurs de coagulation vitamine K-dépendants (VKCFD) ne se présente que rarement comme une affection congénitale. Le VKCFD congénital est hérité de l’une de deux variantes ; toutes deux sont des troubles de la coagulation autosomiques récessifs rares. La présentation clinique plus courante d’une activité déficiente combinée des facteurs de coagulation II (FII), FVII, FIX et FX (et des protéines C, S et Z) se produit en raison d’une carence acquise en vitamine K, résultant notamment d’une maladie du foie, d’une malabsorption ou d’une malnutrition, ou associée à un certain nombre de médicaments, plus particulièrement à un surdosage de warfarine ou de dérivés de la warfarine.
La fonction de chacune des protéines vitamine K-dépendantes (VKDP) dépend de la gamma (Ƴ)-carboxylation normale d’un certain nombre de résidus d’acide glutamique dans la région amino-terminale des protéines (le domaine Gla).1 Cette réaction nécessite un cycle normal de la vitamine K de sa forme réduite à l’état oxydé, suivi d’une régénération de la vitamine K réduite2, 3 Ces réactions sont accomplies par l’action de deux enzymes du réticulum endoplasmique (RE) : la Ƴ-glutamyl carboxylase (GGCX) et la vitamine K 2,3 époxyde réductase complex subunit1 (VKORC1). Les deux variantes du VKCFD sont dues à des défauts dans les gènes qui codent pour ces deux protéines et non à des défauts intrinsèques des facteurs de coagulation. Une activité déficiente de GGCX entraîne le VKCFD1, tandis qu’une activité déficiente de VKORC1 entraîne le VKCFD2. La présentation clinique la plus courante du VKCFD est une hémorragie sévère pendant l’enfance, bien que le degré de déficience soit très variable et que le VKCFD puisse se manifester pendant l’enfance et à l’âge adulte4,5. En outre, il est de plus en plus reconnu que la sous-carboxylation et la fonction déficiente du VKDP affectant les systèmes biologiques en dehors de la coagulation sont fréquentes dans le VKCFD, que leur présentation est très variable et qu’elles peuvent présenter des caractéristiques cliniques considérablement plus tard dans la vie que le phénotype hémorragique, avec des implications pour la surveillance et la gestion du VKCFD.
McMillan et Roberts ont décrit le premier cas d’hémorragie clinique résultant d’une déficience congénitale de la Ƴ-carboxylation en 1966.6,7 Le nourrisson de sexe féminin issu d’une grossesse sans complications a manifesté des ecchymoses à partir de l’âge d’une semaine, avec un suintement sérosanguin récurrent du moignon ombilical pendant les premiers mois de la vie. Lors de la présentation, son temps de prothrombine (PT) était de 95 secondes et son temps de thromboplastine partielle (PTT) de 305 secondes. Après avoir mélangé le plasma de la patiente dans un rapport de 1:1 avec du plasma normal, chacun de ces tests s’est complètement corrigé dans la plage normale et, cliniquement, son hémorragie ombilicale a cessé après une seule perfusion de plasma frais congelé (PFC). Alors que sa numération plaquettaire, son fibrinogène, son FV et son FVIII étaient normaux, l’activité du FII, du FVII, du FIX et du FX étaient tous inférieurs à la limite inférieure de détection (<3%). Après la mise en place d’un programme de thérapie entérale quotidienne à la vitamine K1, l’enfant a grandi et s’est développé normalement, avec seulement une légère tendance aux ecchymoses. Une interruption de la thérapie à la vitamine K1 pendant une période de 9 jours a entraîné le retour d’ecchymoses sévères marquées.
Au cours du demi-siècle qui a suivi, les diagnostics de VKCFD ont été extrêmement rares. La collection la plus complète de cas rapportés de VKCFD1 (anomalie génétique de GGCX associée à de faibles facteurs de coagulation VKDP) comprend moins de 30 lignées ; 5,7 quatre familles avec VKCFD2 ont été décrites.8 Le degré de déficience est variable parmi les cas rapportés. La combinaison particulière de FII, FVII, FIX et FX déficients entraîne des niveaux multiples de génération défectueuse de thrombine. L’activité du substrat, la prothrombine, est elle-même déficiente et, en outre, la production de thrombine via le complexe facteur tissulaire/FVIIa et via le complexe tenase est altérée. La déficience des protéines dans chacune des voies intrinsèque, extrinsèque et commune de la cascade de la coagulation se traduit par un allongement des tests de dépistage PT et aPTT. L’allongement du TP peut être plus marqué que l’allongement du TCA dans les cas plus légers. La Ƴ-carboxylation est également nécessaire à la fonction normale des protéines anticoagulantes C, S et Z ; cependant, la présentation courante et les complications graves de l’IVCC résultent d’une hémorragie plutôt que d’une thrombose9.
L’étiologie complète du VKCFD est devenue claire après le clonage et la caractérisation du gène codant pour la protéine GGCX par Stafford et ses collègues en 199110,11 Stafford et ses collègues et Oldenburg et ses collègues en 2004.12,13,14 Des études généalogiques ultérieures ont conduit à la désignation des deux variantes : VKCFD1, résultant de mutations dans le gène de la Ƴ-glutamyl carboxylase (GGCX), et VKCFD2, résultant de mutations dans le gène du complexe VKOR (VKORC1, ou VKOR).15,16,17
La vitamine K existe sous 3 formes :
- La vitamine K1 (phylloquinone), une vitamine alimentaire importante, est produite par les plantes et les algues et est présente en grande quantité dans les légumes verts et à feuilles. Avec les vitamines A, D et E, la vitamine K1 est une vitamine liposoluble.
- La flore microbienne intestinale normale produit de la vitamine K2 (ménaquinones).
- Une forme synthétique de la vitamine K a été dérivée comme agent pharmacologique avec une plus grande solubilité dans l’eau et désignée vitamine K3 (ménadione).
Les protéines dépendantes de la vitamine K contiennent toutes un domaine Gla riche en acide Ƴ-carboxyglutamique, et le rôle de la vitamine K en tant que cofacteur dans la modification post-traductionnelle appropriée de ce domaine est essentiel à leur fonction normale. Outre les protéines impliquées dans la coagulation, il est de plus en plus évident qu’une variété de processus biologiques sont affectés par les protéines dépendantes de la vitamine K (PDVK) et que l’expression phénotypique de la sous-carboxylation peut être associée à des manifestations hémorragiques et non hémorragiques. (Voir « Manifestations cliniques ».) Outre l’implication des protéines anticoagulantes C et S dans l’inflammation, l’action de la protéine riche en Gla (GRP) dans les monocytes/macrophages est impliquée dans l’interaction entre inflammation et calcification. L’ostéocalcine, une VKDP dérivée des ostéoblastes, est impliquée dans le métabolisme du glucose et associée à la formation et à la solidité normales des os. D’autres VKDP sont impliqués dans la régulation de la prolifération cellulaire (protéine Growth Arrest Specific gene 6, Gas6) et dans l’inhibition de la calcification vasculaire et de la minéralisation des tissus (protéine Gla matricielle, MGP), tandis que la fonction de plusieurs autres VKDP est actuellement inconnue, notamment les protéines Gla transmembranaires (TMG) et les protéines Gla riches en proline (PRGP).2,18, 19, 20
Les facteurs de coagulation II, VII, IX et X et les protéines C, S et Z contiennent de 9 à 13 glutamates (Glu) dans la séquence d’acides aminés de leurs domaines Gla respectifs. Une modification post-traductionnelle insuffisante de ces glutamates en acide Ƴ-carboxyglutamique (Gla) est l’étape enzymatique qui est défectueuse dans les deux variantes du VKCFD. La carboxylation du domaine Gla confère une conformation dépendante du calcium qui est essentielle à l’interaction normale des protéines avec les phospholipides (par exemple, avec la surface phospholipidique de la plaquette activée) ou avec les cellules endothéliales. Le GGCX est la protéine qui effectue cette modification post-traductionnelle ; toutefois, la vitamine K sous sa forme réduite est également nécessaire pour agir en tant que cofacteur. La vitamine K réduite est convertie en époxyde de vitamine K au cours de la réaction, et la forme réduite doit être régénérée pour des cycles supplémentaires de catalyse par l’action de VKOR. L’anticoagulant warfarine s’oppose à l’action du VKOR, de sorte qu’une personne prenant de la warfarine a une régénération altérée de la vitamine K réduite, avec un résultat contrôlé similaire à la carence en vitamine K ou au VKCFD : excès de FII, FVII, FIX et FX sous-carboxylés et fonctionnellement déficients. 2,3 Les cycles de la vitamine K peuvent être visualisés comme le montre la figure 1.
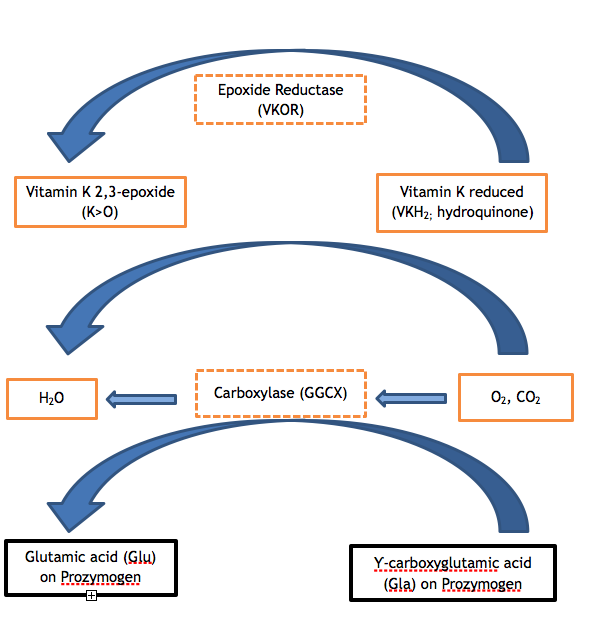
Figure 1. Le cycle de la vitamine K. La carboxylation des résidus d’acide glutamique des protéines zymogènes vitamine K-dépendantes est nécessaire à leur bon fonctionnement. La carboxylase (GGCX) ajoute une molécule de dioxyde de carbone à Glu pour former Gla dans une réaction pour laquelle la vitamine K est un cofacteur essentiel. La forme réduite de la vitamine K (hydroquinone) est oxydée dans le processus, ce qui donne de la vitamine K 2,3-époxyde. La vitamine K réduite doit être régénérée à partir de l’époxyde par l’action enzymatique de VKOR afin que la vitamine K réduite soit disponible pour servir de cofacteur aux réactions de carboxylation ultérieures. Une activité déficiente de l’une ou l’autre des enzymes VKOR ou GGCX (voir les cases hachurées sur la figure) entraîne la VKCFD.
Il ressort de cette discussion que si les VKDP sont synthétisées et sécrétées normalement, la fonction des protéines est anormale en raison d’une carboxylation post-traductionnelle insuffisante.
La purification de GGCX et VKORC1, qui sont des protéines membranaires intégrales, a été difficile et les structures cristallines de ces protéines ne sont pas encore résolues. Néanmoins, une compréhension des domaines fonctionnels de ces protéines est en train d’émerger.1 Cet effort est complété par des efforts récents pour corréler les défauts génétiques affectant des régions spécifiques des enzymes avec la gravité et le spectre de l’activité déficiente du VKDP, à la fois dans le système de coagulation et dans d’autres processus physiologiques. 5,8,21,22
Le gène GGCX sur le bras p du chromosome 2 code pour une protéine transmembranaire de 758 acides aminés (AA) qui est localisée sur la membrane du réticulum endoplasmique. La partie N-terminale de l’enzyme est cytoplasmique. Cinq domaines transmembranaires suivent, localisés dans la membrane lipidique du RE. La partie C-terminale de la protéine est intraluminale dans le RE. La région intraluminale contient des domaines hydrophobes importants pour l’interaction avec la vitamine K. Un domaine fonctionnel important (proposé comme étant les AA 491-507) interagit avec le propeptide du VKDP, tandis qu’une autre région de liaison (AA 393-404) pour le glutamate du VKDP facilite la gamma-carboxylation. En fait, la première corrélation du phénotype clinique du VKCFD avec une mutation du gène GGCX décrivait une substitution de la leucine par l’arginine en position 394 de la région de liaison du glutamate.15 Bien que la séquence des quatre premiers domaines transmembranaires du GGCX soit hautement conservée au cours de l’évolution, leur fonction chez l’homme n’est pas connue. La protéine décrite ici est exprimée à partir du gène GGCX complet. Une isoforme 2 de l’ARNm GGCX dépourvue de l’exon 2 (Δ2GGCX) peut coder une protéine qui conserve une activité enzymatique, bien que la signification physiologique de cette isoforme ne soit pas déterminée (voir également « Héritage et mutations causales »).23
Le gène VKOR du chromosome 16 code une protéine transmembranaire de 163 AA. La topologie membranaire de base de la protéine VKOR est controversée : par exemple, le débat se poursuit pour savoir si la protéine a trois ou quatre domaines transmembranaires, et si le site actif hautement conservé VKOR C132XXC135 pour l’attaque nucléophile de la vitamine K est cytoplasmique ou à l’intérieur de la lumière du RE. Une région structurelle importante impliquant les groupements arginine aux AA 98 et 100 constitue un motif de rétention ER di-arginine qui est nécessaire pour maintenir VKOR localisé dans le site d’activité requis. Une seule mutation de VKOR (VKORC1p.Arg98Trp) est à l’origine de tous les cas de VKCFD2, et il n’existe donc pas de corrélation génotype/phénotype permettant de comprendre les interactions enzymatiques fonctionnelles de la réductase (comme c’est le cas pour VKCFD1). 1,8,24,25
Il est possible que des gènes supplémentaires qui modifient l’action de ces protéines ne soient pas encore identifiés. Les données animales suggèrent toutefois qu’une voie indépendante et redondante de la carboxylase n’existe pas dans tous les tissus, à la lumière de la létalité embryonnaire des souris knockout GGCX et knockout VKOR26,27. Au moment de l’identification de la protéine VKOR, Rost et ses collègues ont identifié une protéine paralogue appelée VKOR-like 1 (VKORL1), qui est capable de réduire la K>O;13 un rôle pour VKORL1 pour sauver une certaine fonction de la vitamine K dans les tissus extra-hépatiques pendant l’anticoagulation avec des antagonistes de la vitamine K a été suggéré.1 Aucune donnée ne suggère que VKORL1 joue un rôle physiologique important dans le soutien de la carboxylation hépatique des facteurs de coagulation, de sorte que la protéine paralogue n’est pas considérée comme pertinente pour le VKCFD à l’heure actuelle.
Le VKCFD est très rare. La collection la plus complète de cas publiés de VKCFD1 (dans lequel une mutation génétique dans GGCX est présente en association avec une diminution de l’activité des facteurs de coagulation) comprend 33 personnes affectées (26 probands distincts).5 Aucune influence de la race ou de l’ethnicité n’a été décrite, et des cas ont été rapportés en Afrique, en Asie, en Europe, en Amérique du Nord et en Amérique du Sud.7,21,28 Le VKCFD2 est plus rare, avec 10 cas rapportés dans quatre familles d’origine nord-américaine caucasienne, allemande, italienne et libanaise.8