XeF2 est l’abréviation du composé chimique difluorure de xénon. C’est un puissant agent de fluoration ainsi qu’un agent oxydant. Outre le XeF2, il existe d’autres composés du xénon tels que le XeF4 (tétrafluorure de xénon) et le XeF6 (hexafluorure de xénon). Parmi ces composés, le XeF2 est le plus stable. C’est un solide cristallin blanc
utilisé à des fins de fluoration dans les procédures électrochimiques et les laboratoires. Le XeF2 a une odeur nauséabonde typique et se décompose au contact de la vapeur ou de la lumière.
Il est vital de connaître sa structure de Lewis, son hybridation et sa polarité pour comprendre les propriétés chimiques ainsi que la géométrie moléculaire du composé. Alors comprenons maintenant toutes les propriétés en détail.
Contenu
Structure de Lewis du Xef2
La structure de Lewis d’un composé chimique donné est cruciale pour connaître toutes les propriétés physiques et chimiques. C’est une représentation imagée de tous les électrons qui participent à la formation des liaisons. Cette structure aide à comprendre les charges des molécules du composé. Les électrons qui participent à la formation des liaisons, ainsi que ceux qui n’y participent pas, sont collectivement appelés électrons de valence.
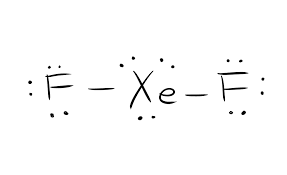
Les électrons qui participent à la formation des liaisons sont appelés paires d’électrons de liaison. Ceux qui ne participent pas à la formation des liaisons sont appelés paires d’électrons solitaires. Pour distinguer les différents types d’électrons, les paires d’électrons de liaison et les paires d’électrons solitaires sont représentées différemment. Les formations de liaison dans le composé sont représentées par des lignes droites et les paires solitaires sont représentées par des points.
La structure de Lewis est basée sur la règle de l’octet. Cette règle stipule que chaque molécule doit avoir huit électrons dans sa coquille externe d’un atome pour être stable. S’il y a plus d’électrons que cela, alors ce composé donne l’électron. Alors que s’il y a moins de huit électrons, le composé accepte les électrons de l’autre molécule pour être stable.
Donc pour ce composé XeF2, il y a une molécule de Xénon et deux molécules de Fluor. Une seule molécule de Xénon possède huit électrons, et une molécule de Fluor possède sept électrons de valence.
Nombre total d’électrons de valence = Nb d’électrons de valence pour le Xénon + Nb. d’électrons de valence pour le Fluor
=8+ 7*2
=8+14
=22
Le nombre total d’électrons de valence pour XeF2=22.
Hybridation du Xef2

L’hybridation d’une molécule donnée est vitale pour comprendre la géométrie de la molécule. Lors de la formation de la liaison, deux orbitales ou plus avec des niveaux d’énergie différents se combinent et forment des orbitales hybrides. Dans XeF2, la coquille externe du xénon possède huit électrons dont deux participent à la formation de la liaison.
L’état fondamental du Xénon possède 8 électrons disposés dans des orbitales s2 p6. Alors que dans le XeF2, la molécule de Xe possède un état excité. L’arrangement des électrons du Xénon change en s2 p5 d1 avec deux électrons non appariés. Par conséquent, l’hybridation de l’atome central Xe est sp3d. Ainsi, l’hybridation de la molécule XeF2 est sp3d.
Géométrie moléculaire du Xef2

Généralement, la structure de Lewis est utile pour comprendre la géométrie moléculaire de tout composé chimique donné. Mais comme le Xénon ne forme pas facilement des liaisons, ce composé est un cas exceptionnel. La géométrie moléculaire du difluorure de xénon peut être comprise en connaissant la théorie VSEPR. Cette théorie est basée sur le nombre stérique de l’atome central et les électrons de valence du composé. VSEPR est une abréviation de Valence Shell Electron Pair repulsion theory.
Ici, le nombre stérique de l’atome central de Xénon est de 5. Cela signifie qu’une seule molécule de Xénon peut former des liaisons avec cinq molécules. Mais ici, dans XeF2, il forme des liaisons avec deux atomes de fluor seulement. Pour le xénon, deux électrons sur huit forment des liaisons avec les atomes de fluor. Ces six électrons sont maintenant les électrons non liants. Ces trois paires d’électrons solitaires s’étalent dans un arrangement qui est en position équatoriale par rapport aux paires d’électrons liés.
La forme de la molécule devrait être bipyramidale trigonale selon l’hybridation, mais elle ne l’est pas. XeF2 est une molécule linéaire en raison de l’arrangement des atomes de fluor et des paires d’électrons solitaires dans l’arrangement symétrique.
Angle de liaison
Maintenant que nous connaissons la géométrie moléculaire de la molécule de difluorure de xénon, l’angle de liaison peut être compris facilement. Il y a deux paires d’électrons liés et trois paires d’électrons solitaires. Les paires solitaires sont en position équatoriale par rapport aux paires liées. L’angle de liaison entre les deux paires liées à l’atome central est de 180 degrés, ce qui rend la géométrie moléculaire de XeF2 linéaire.
Polarité du Xef2
![]()
La polarité d’une molécule donnée dépend de la géométrie moléculaire et de l’hybridation du composé. Dans la molécule XeF2, deux atomes de fluor sont disposés symétriquement à l’extérieur avec l’atome central Xénon au milieu. Il n’y a pas de moment dipolaire net dans le composé en raison de la disposition symétrique des électrons de valence. Par conséquent, le difluorure de xénon est non polaire car il n’y a pas de polarité observée dans la molécule.
Marques finales
Pour résumer l’article, on peut conclure que XeF2 possède 22 électrons de valence, parmi lesquels il y a trois paires d’électrons solitaires. Son hybridation est sp3d. Selon la théorie VSEPR, la géométrie moléculaire de la molécule est linéaire. L’angle de liaison de F-Xe-F est de 180 degrés. Comme il y a des molécules de fluor des deux côtés de l’atome central, il n’y a pas de moment dipolaire et donc pas de polarité. XeF2 est non polaire en raison de l’arrangement symétrique des paires d’électrons liées.