Svante Arrhenius schlug 1889 die Arrhenius-Gleichung aus seinen direkten Beobachtungen der Plots von Geschwindigkeitskonstanten gegen Temperaturen vor:
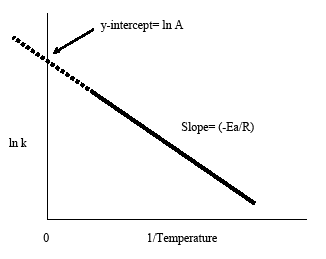
Die Aktivierungsenergie, Ea, ist die Energie, die Moleküle mindestens besitzen müssen, um unter Bildung eines Produktes zu reagieren. Die Steigung des Arrhenius-Plots kann verwendet werden, um die Aktivierungsenergie zu ermitteln. Der Arrhenius-Plot kann auch durch Extrapolation der Linie zurück zum y-Schnittpunkt verwendet werden, um den vorexponentiellen Faktor A zu erhalten. Dieser Faktor ist von Bedeutung, da A=p×Z ist, wobei p ein sterischer Faktor und Z die Kollisionsfrequenz ist. Der vorexponentielle Faktor oder Frequenzfaktor bezieht sich auf die Häufigkeit, mit der die Moleküle in der für eine Reaktion notwendigen Orientierung aufeinandertreffen. Es ist wichtig zu beachten, dass die Arrhenius-Gleichung auf der Kollisionstheorie basiert. Sie besagt, dass Teilchen mit der richtigen Ausrichtung und mit genügend Energie zusammenstoßen müssen. Nachdem wir nun die Aktivierungsenergie und den vorexponentiellen Faktor aus dem Arrhenius-Diagramm erhalten haben, können wir die Geschwindigkeitskonstante bei jeder Temperatur mit Hilfe der Arrhenius-Gleichung bestimmen.
Das Arrhenius-Diagramm erhält man, indem man den Logarithmus der Geschwindigkeitskonstante, k, gegen die inverse Temperatur, 1/T, aufträgt. Die resultierende negativ geneigte Linie ist nützlich, um die fehlenden Komponenten der Arrhenius-Gleichung zu finden. Die Steigung der Linie ist gleich der negativen Aktivierungsenergie geteilt durch die Gaskonstante R. Als Faustregel für die meisten biologischen und chemischen Reaktionen gilt, dass sich die Reaktionsgeschwindigkeit verdoppelt, wenn die Temperatur alle 10 Grad Celsius steigt.
Betrachtet man die Arrhenius-Gleichung, so enthält der Nenner der Exponentialfunktion die Gaskonstante R und die Temperatur T. Dies ist nur der Fall, wenn es sich um Mole einer Substanz handelt, da R die Einheit J/molK hat. Wenn es sich um Moleküle eines Stoffes handelt, wird die Gaskonstante im Dominator der Exponentialfunktion der Arrhenius-Gleichung durch die Boltzmann-Konstante, kB, ersetzt. Die Boltzmann-Konstante hat die Einheit J/K. Bei Raumtemperatur ist kBT die verfügbare Energie für ein Molekül bei 25 C oder 273K und entspricht etwa 200 Wellenzahlen.
Es ist wichtig zu beachten, dass die Entscheidung, die Gaskonstante oder die Boltzmann-Konstante in der Arrhenius-Gleichung zu verwenden, in erster Linie von der Aufhebung der Einheiten abhängt. Um den inversen Logarithmus einer Zahl zu nehmen, muss die Zahl einheitenlos sein. Daher müssen sich alle Einheiten im Exponentialfaktor aufheben. Wenn die Aktivierungsenergie in Joule pro Mol angegeben ist, sollte die Gaskonstante im Dominator verwendet werden. Ist die Aktivierungsenergie jedoch in der Einheit Joule pro Molekül, dann sollte die Konstante K verwendet werden.
- Arrhenius-Gleichung pro Mol \
- Arrhenius-Gleichung pro Molekül \
„Linearisierte“ Arrhenius-Gleichung
Die Arrhenius-Gleichung (Gleichung \ref{eq1}) kann umgestellt werden, um bestimmte Situationen zu behandeln. Wenn man zum Beispiel den Logarithmus beider Seiten nimmt, erhält man die obige Gleichung in der Form y=-mx+b.
Dann kann ein Plot von \(\ln k\) vs. \(1/T\) und allen Variablen gefunden werden.
- \(y=ln k\)
- \(m=-Ea/RT\)
- \(x=1/T\)
- \(b=\ln A\)
Diese Form der Arrhenius-Gleichung macht es einfach, die Steigung und den y-Abschnitt aus einem Arrhenius-Plot zu bestimmen. Es ist auch praktisch zu beachten, dass die obige Gleichung den Zusammenhang zwischen Temperatur und Geschwindigkeitskonstante zeigt. Mit steigender Temperatur nimmt die Ratenkonstante gemäß der Darstellung ab. Aus diesem Zusammenhang kann man schließen, dass die Ratenkonstante umgekehrt proportional zur Temperatur ist.
Integrierte Form
Die integrierte Form der Arrhenius-Gleichung ist ebenfalls nützlich (Gleichung \ref{eq3}). Bei dieser Variante der Arrhenius-Gleichung werden zur Bestimmung der Aktivierungsenergie zwei Arrhenius-Diagramme verwendet, die auf demselben Graphen aufgebaut sind. Die obige Gleichung zeigt den Einfluss der Temperatur auf mehrere Geschwindigkeitskonstanten. Dies ermöglicht einen einfachen Rückschluss auf die Empfindlichkeit der Geschwindigkeitskonstanten gegenüber Aktivierungsenergie und Temperaturänderungen. Wenn die Aktivierungsenergie für einen bestimmten Temperaturbereich hoch ist, dann ist die Geschwindigkeitskonstante sehr empfindlich; Temperaturänderungen haben einen signifikanten Einfluss auf die Geschwindigkeitskonstante. Wenn die Aktivierungsenergie für einen gegebenen Temperaturbereich niedrig ist, dann ist die Geschwindigkeitskonstante weniger empfindlich, und Temperaturänderungen haben nur geringe Auswirkungen auf die Geschwindigkeitskonstante. Dieses Phänomen wird im folgenden Beispiel grafisch dargestellt:
| 1/Temp | 0.0085 | 0.0075 | 0.0065 | 0.0055 | 0.0045 | 0.0035 |
|---|---|---|---|---|---|---|
| lnk (große Ea) | 3 | 2.5 | 2 | 1.5 | 1 | 0.5 |
| lnk (klein Ea) | 1.8 | 1.7 | 1.6 | 1.5 | 1.4 | 1.3 |
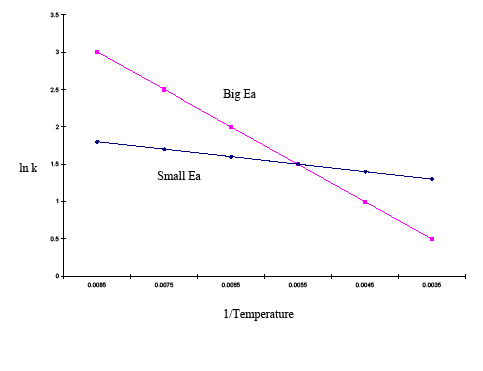
Das obige Diagramm zeigt, dass die Kurve mit der steileren Steigung eine höhere Aktivierungsenergie hat und die Kurve mit der flacheren Steigung eine kleinere Aktivierungsenergie. Das bedeutet, dass über den gleichen Temperaturbereich eine Reaktion mit einer höheren Aktivierungsenergie schneller abläuft als eine Reaktion mit einer niedrigeren Aktivierungsenergie.
Biologische Bedeutung
Das Arrhenius-Diagramm kann nichtlinear werden, wenn die Schritte bei unterschiedlichen Temperaturen ratenlimitierend werden. Ein solches Beispiel findet sich bei Fox und Mitarbeitern 1972 beim Beta-Glykosid-Transport in E. coli. Die Unterschiede in den Übergangstemperaturen sind auf die Fettsäurezusammensetzung in den Zellmembranen zurückzuführen. Der Unterschied der Übergangszustände resultiert aus der starken Änderung der Fluidität der Membran. Ein weiteres Beispiel ist der plötzliche Abfall bei niedrigen 1/T (hohe Temperaturen), eine Folge der Denaturierung von Proteinen.
Key Points
- Arrhenius-Diagramme zeigen, dass Reaktionsgeschwindigkeiten umgekehrt proportional zu Temperaturänderungen sind
- Die negative Steigung aus dem Arrhenius-Diagramm ergibt die Aktivierungsenergie, Ea: Steigung = -Ea/R
- Die Extrapolation des Arrhenius-Diagramms zurück zum y-Achsenabschnitt ergibt lnA
- Das Arrhenius-Diagramm zeigt, wie Aktivierungsenergie und Temperatur die Empfindlichkeit der Reaktionsgeschwindigkeit beeinflussen
Praxisprobleme
1. T/F Das aus der Arrhenius-Gleichung berechnete Ea ergibt einen exakten Wert.
2. Beschreiben Sie den Zusammenhang zwischen Temperatur und Ea und geben Sie Beispiele an.
3. Verwenden Sie folgende Informationen:
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8.314 J mol/K
Berechnen Sie k bei 27° C mit den richtigen Einheiten.
4. Berechnen Sie k bei 37° C mit den richtigen Einheiten unter Verwendung der Informationen aus Aufgabe 3.
5. Lösen Sie Ea mithilfe der integrierten Gleichung wie folgt:
k1=7,78×10-7 bei T1=273 K
k2=3,46×10-5 bei T2=298 K
Antworten
- Falsch: Ea ist ein durchschnittlicher oder „scheinbarer“ Wert.
- Wenn die Temperatur steigt, nimmt die Geschwindigkeitskonstante ab, wenn die obige Gleichung aufgetragen wird. Dasselbe gilt, wenn die Temperatur sinkt, steigt die Geschwindigkeitskonstante. Aus diesem Zusammenhang ergibt sich, dass die Geschwindigkeitskonstante umgekehrt proportional zur Temperatur ist.
- k= 8,727 sec-1
- k=23,02 sec-1
- Ea=1.026×105 J/mol
Beiträger und Zuschreibungen
- David Johns und Andra Hutton (UC Davis)