Fakten, Zusammenfassung & Definition
- Allosterische Enzyme sind Enzyme, die neben der aktiven Stelle eine zusätzliche Stelle haben, an die ein Effektor binden kann, neben der aktiven Stelle
- Effektoren regulieren die Aktivität des Enzyms – sie können entweder aktivieren oder hemmen
- Allosterische Enzyme sind größer und komplexer als normale Enzyme
- Sie werden durch homotrope Regulation oder heterotrope Regulation reguliert
Was sind allosterische Enzyme?
Sie werden sich erinnern, dass Enzyme zu den biologischen Katalysatoren gehören. Das heißt, sie helfen, die Geschwindigkeit einer Reaktion zu beschleunigen, bleiben aber während des gesamten Prozesses unverändert.
Allosterische Enzyme sind Enzyme, die neben der aktiven Stelle eine zusätzliche Stelle haben – das Wort kommt vom griechischen „allo“, was „andere“ bedeutet. Diese werden allosterische Stellen genannt, und Enzyme können mehr als eine haben. Sie sind insofern einzigartig, als sie die Fähigkeit haben, auf mehrere verschiedene Bedingungen in ihrer unmittelbaren Umgebung zu reagieren. Wenn allosterische Enzyme in einem Diagramm als Geschwindigkeit gegen die Substratkonzentration dargestellt werden, zeigen sie eine sigmoidale Kurve und nicht die übliche hyperparabolische Kurve.
Das Bild unten zeigt ein generisches allosterisches Enzym.

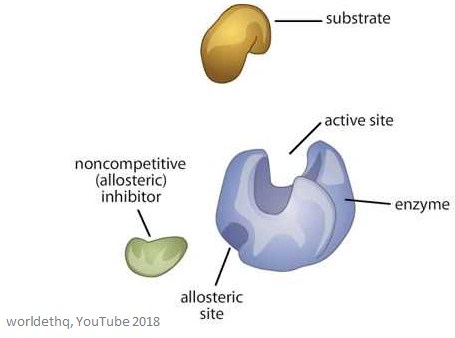
Eigenschaften von allosterischen Enzymen
Allosterische Stellen sind Bindungsstellen auf dem Enzym – sie unterscheiden sich von der aktiven Stelle und der Substratbindungsstelle.
Das Molekül, das an die allosterische Stelle bindet, wird Effektor genannt (es kann auch Modulator genannt werden), und es reguliert die Aktivität des Enzyms, an das es bindet.
Die Aktivität des Enzyms wird erhöht, wenn ein positiver allosterischer Effektor an die allosterische Stelle bindet. Das bedeutet, dass die Aktivität des Enzyms verringert wird, wenn ein negativer allosterischer Effektor an die allosterische Stelle bindet – sie hemmen das Enzym.
Allosterische Enzyme sind größer und komplexer als nicht-allosterische Enzyme und haben oft viele Untereinheiten. Enzyme mit mehr als einem Effektor haben unterschiedliche und spezifische Bindungsstellen für jeden einzelnen. Bei den meisten allosterischen Enzymen befinden sich die Substratbindungsstelle und die Effektor-Bindungsstelle auf unterschiedlichen Untereinheiten.
Die Substratbindungsstelle befindet sich auf der katalytischen Untereinheit – oft auch als C-Untereinheit bezeichnet. Die Effektor-Bindungsstelle befindet sich auf der regulatorischen Untereinheit – oft als R-Untereinheit bezeichnet.
Wenn ein Effektormolekül an einer Bindungsstelle eine Konformationsänderung an dieser Untereinheit verursacht, dann wird auch eine Konformationsänderung in den anderen Untereinheiten des Proteins verursacht – das bedeutet, dass ein großer Teil der Bindungsenergie des Effektors verwendet wird, um die Konformation des gesamten Proteinkomplexes zu ändern.
Diese Wechselwirkung zwischen allen Untereinheiten kann durch den Hill-Koeffizienten ausgedrückt werden – dieser wird auch Kooperativitätskoeffizient genannt. Wenn n=1 ist, gibt es keine Wechselwirkung zwischen den Untereinheiten des Enzyms. Je größer der Hill-Koeffizient (Kooperativitätskoeffizient) ist, desto stärker sind die Wechselwirkungen zwischen allen Untereinheiten im Enzym.
Allosterische Enzyme können auch zwischen ihrer aktiven Form und ihrer inaktiven Form „umschalten“. Dies ermöglicht ausgeklügelte Reaktionsmuster in der Aktivität, die für die biologische Funktion eine große Rolle spielen können. Sobald der Effektor von der Bindungsstelle dissoziiert, ist das Enzym in der Lage, wieder in seine inaktive (oder weniger aktive) Form zurückzukehren. Sie können die Raten sehr wichtiger Reaktionen kontrollieren, wie z. B. die ATP-Produktion.
Wenn ein Effektor an ein Enzym bindet, spricht man von kooperativer Bindung.
Homotrope Regulation
Ein homotroper allosterischer Effektor ist sowohl ein Substrat für das Enzym als auch ein regulatorisches Molekül – die Vorsilbe „homo“ bezieht sich darauf, dass sie dasselbe sind. Sie sind normalerweise Aktivatoren des Enzyms. Die folgende Abbildung zeigt einen homotropen allosterischen Effektor.

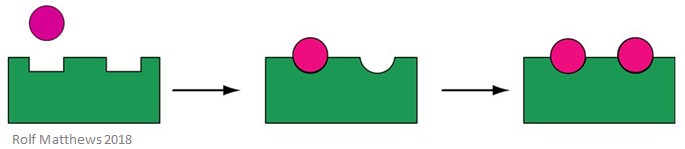
Ein gutes Beispiel für einen homotropen allosterischen Effektor ist Sauerstoff (O2) – er wirkt als Effektor des Hämoglobins im menschlichen Körper.
Heterotrope Regulation
Ein heterotroper allosterischer Effektor ist ein regulatorisches Molekül, das nicht gleichzeitig das Substrat für das Enzym ist. Es kann das Enzym, an das es bindet, entweder aktivieren oder hemmen. Die folgende Abbildung zeigt einen heterotropen allosterischen Effektor.

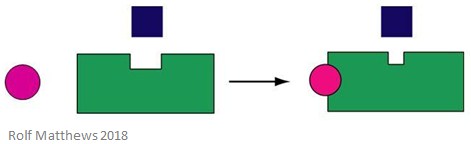
Ein gutes Beispiel für einen heterotropen allosterischen Effektor ist Kohlendioxid (CO2) – es wirkt ebenfalls als Effektor von Hämoglobin, ist aber nicht das Substrat des Enzyms.
Essentielle Aktivatoren
Essentielle Aktivatoren sind allosterische Aktivatoren, ohne die die Enzymaktivität so gering wäre, dass sie vernachlässigbar wäre. Zum Beispiel ist N-Acetylglutamat ein essentieller Aktivator für die Carbamoylphosphat-Synthetase I. Sie sind das genaue Gegenteil von Enzyminhibitoren.