Eigenschaften von ionischen Verbindungen
Da alle ionischen Verbindungen entstehen, wenn sich Anionen und Kationen zueinander hingezogen fühlen, haben ionische Verbindungen häufig ähnliche Eigenschaften.
Ionische Verbindungen bilden Kristalle
Ionische Verbindungen bestehen aus Kationen und Anionen, die aufgrund ihrer entgegengesetzten Ladungen aneinander haften. Stellen Sie sich vor, ein einzelnes Lithiumkation klebt neben einem einzelnen Chloranion und bildet Lithiumchlorid. Nun ist es unwahrscheinlich, dass an dieser Stelle nur ein Lithium-Ion und ein Chlorid-Ion vorhanden sind… Im Allgemeinen sprechen wir, wenn wir von chemischen Reaktionen sprechen, über eine riesige Anzahl von Atomen, die eine Reaktion an einem sehr kleinen Ort durchlaufen (ein Teelöffel Salz enthält ungefähr 1022 Atome). Wenn also unser einzelnes LiCl-Paar in die Nähe eines anderen LiCl-Paares käme, würde folgendes passieren:
Da sich entgegengesetzt geladene Ionen gegenseitig anziehen, werden die LiCl-Paare dazu neigen, größere Gruppen zu bilden. Diese größeren Gruppen bilden wiederum noch größere Gruppen von Ionen, wie in der folgenden Abbildung gezeigt:
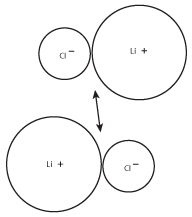
Abbildung 8.3Die positive Ladung des Lithiumkations des einen Paares wird von der negativen Ladung des Chloridions des anderen Paares angezogen.

Abbildung 8.4Dieser Prozess, bei dem sich Stapel von LiCl-Ionen miteinander verbinden, setzt sich fort, bis keine Lithium- oder Chlorid-Ionen mehr vorhanden sind.
Kristalle sind große Anordnungen von Ionen oder Atomen, die in regelmäßigen Mustern gestapelt sind. Viele ionische Verbindungen bilden sehr große Kristalle.
Diese großen Anordnungen von Ionen werden als Kristalle bezeichnet. Obwohl Kristalle häufig aus ionischen Verbindungen gebildet werden, gibt es sie auch in einigen anderen chemischen Verbindungen, wie z. B. Diamanten. Wir werden darüber in Festkörper ausführlicher sprechen.
Hydrate werden gebildet, wenn sich ein oder mehrere Wassermoleküle an ionische Verbindungen anlagern. Diese Verbindungen sind interessant, weil sie trocken erscheinen, aber beim Erhitzen Wasser abgeben. Besonders interessant ist Bittersalz, oder Magnesiumsulfat-Heptahydrat (MgSO47H2O). Beim Erhitzen wird so viel Wasser abgegeben, dass es das Magnesiumsulfat tatsächlich auflöst!
Ionische Verbindungen haben oft hohe Schmelz- und Siedepunkte
Was passiert, wenn Sie in Ihrer Küche etwas erhitzen? Vielleicht haben Sie beim Kochen (oder beim Erhitzen beliebiger Dinge in der Mikrowelle, wenn Ihnen langweilig war) festgestellt, dass die meisten Lebensmittel, die wir essen, entweder schmelzen oder verbrennen, wenn sie erhitzt werden. Manche Lebensmittel tun sogar beides! Wie Sie wahrscheinlich erraten können, bin ich ein Experte, wenn es darum geht, Hausbrände zu löschen.
Ionische Verbindungen hingegen schmelzen und kochen häufig bei viel höheren Temperaturen als andere Materialien. Damit ionische Verbindungen schmelzen, muss genug Energie zugeführt werden, damit sich die Kationen und Anionen voneinander wegbewegen. Da diese Anziehungskräfte so stark sind, braucht es viel Energie, um diese Ionen auseinander zu ziehen. Die Zuführung dieser Energie zu ionischen Verbindungen erfordert eine große Menge an Wärme, weshalb ionische Verbindungen sehr hohe Schmelz- und Siedepunkte haben.
Ionische Verbindungen sind hart und spröde
Stellen Sie sich vor, Sie schlagen einen großen Brocken Lithiumchlorid gegen Ihren Kopf. Was glauben Sie, wie sich das anfühlen würde? Wenn Sie erraten haben, dass es wie verrückt wehtun würde, hatten Sie recht. Wie viele ionische Verbindungen ist Lithiumchlorid hart wie ein Stein.
Ionische Verbindungen sind extrem hart, weil es schwierig ist, die Ionen in einem Kristall auseinander zu bewegen. Selbst wenn Sie eine große Kraft auf den Kristall ausüben (stellen Sie sich vor, Sie rennen kopfüber in eine riesige Wand aus Lithiumchlorid), wird die Anziehungskraft zwischen den Kationen und Anionen den Kristall häufig weiterhin zusammenhalten.
Sagen wir jedoch, dass Sie eine ionische Verbindung wirklich auseinanderbrechen wollen. Ionische Verbindungen sind zwar sehr hart, aber häufig auch sehr spröde, d.h. sie brechen auseinander, wenn man die richtige Art von Kraft auf sie ausübt. Wie die folgende Abbildung zeigt, ist es genauso wichtig, wo man die Kraft anwendet, wie wie viel Kraft man einsetzt.

Abbildung 8.5Indem man Kraft so anwendet, dass die Kationen und Anionen voneinander getrennt werden, kann man einen Kristall vollständig auseinanderbrechen lassen.
Wie Sie in diesem Diagramm sehen können, richten sich ionische Kristalle so aus, dass es Bereiche gibt, in denen eine kleine Kraft den Kristall auseinanderbrechen lassen kann. Diese Bereiche werden manchmal als „Spaltungsebenen“ bezeichnet, weil sie die Stellen sind, an denen der Kristall am schwächsten ist und am leichtesten gebrochen werden kann.
Ionische Verbindungen leiten Elektrizität, wenn sie in Wasser gelöst oder geschmolzen werden
Es war einmal ein Erfinder, der ein Gerät zum Trocknen von Haaren erfand. Dieser „Föhn“, wie er ihn nannte, erhitzte Luft mit Strom und blies sie über das Haar der Person, die ihn hielt. Da Wasser beim Erhitzen verdampft, trockneten die Haare schneller. Das Vermächtnis dieses Erfinders lebt bis heute in einem von Millionen geliebten Haushaltsgerät weiter.
Elektrolyte sind Verbindungen, die Elektrizität leiten, wenn sie in Wasser gelöst sind. Viele ionische Verbindungen werden zu den Elektrolyten gezählt. Einige ionische Verbindungen lösen sich jedoch nicht in Wasser. Daher haben sie diese Eigenschaft nicht.
Kurz darauf gab es einen Typen, der beschloss, dass er nicht warten wollte, bis er aus der Badewanne stieg, bevor er sein Haar trocknete. Sein Vermächtnis: Ein Haartrockner-Warnaufkleber mit dem Bild eines Mannes, der einen Stromschlag bekommt.
Wenn ionische Verbindungen in Wasser gegeben werden, bewirken sie, dass das Wasser Elektrizität leitet. Normalerweise leitet Wasser Elektrizität überhaupt nicht gut. Wenn sich jedoch Salze in Wasser auflösen, zerfallen sie in ihre Bestandteile Kationen und Anionen, und es ist das Vorhandensein dieser Ionen, das es ermöglicht, Elektrizität zu leiten. Da Salze Elektrizität leiten, wenn sie in Wasser gelöst sind, werden sie als Elektrolyte bezeichnet.
Auf die gleiche Weise leiten reine Salze auch Elektrizität, wenn sie geschmolzen werden. Als Feststoff sind die Anionen und Kationen in einer ionischen Verbindung an ihrem Platz eingesperrt und können keine elektrische Ladung bewegen. Wenn die ionische Verbindung jedoch geschmolzen wird, können sich diese Ionen frei bewegen und Ladung leiten.
Auszug aus The Complete Idiot’s Guide to Chemistry 2003 von Ian Guch. Alle Rechte vorbehalten, auch das Recht der Vervielfältigung im Ganzen oder in Teilen in jeder Form. Verwendet nach Absprache mit Alpha Books, einem Mitglied der Penguin Group (USA) Inc.
Um dieses Buch direkt beim Verlag zu bestellen, besuchen Sie die Website von Penguin USA oder rufen Sie 1-800-253-6476 an. Sie können dieses Buch auch bei Amazon.com und Barnes & Noble erwerben.