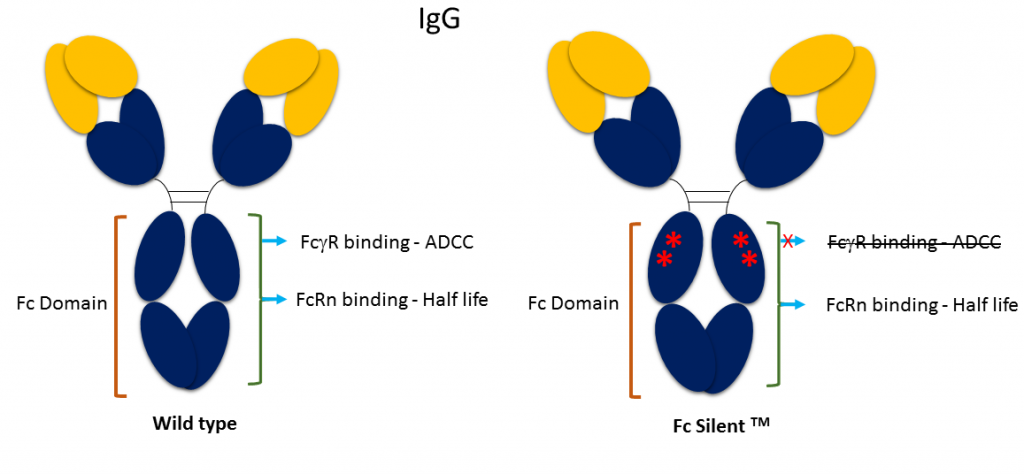
 Fc Silent™ ist eine gentechnisch veränderte Fc-Domäne, die bei Absolute Antibody für die Forschung und Testentwicklung entwickelt wurde. Sie enthält wichtige Punktmutationen, die die Bindung von Fc-Rezeptoren (FcγR, FcR) aufheben und damit die Effektor-Funktion der Antikörper-gerichteten Zytotoxizität (ADCC) aufheben.
Fc Silent™ ist eine gentechnisch veränderte Fc-Domäne, die bei Absolute Antibody für die Forschung und Testentwicklung entwickelt wurde. Sie enthält wichtige Punktmutationen, die die Bindung von Fc-Rezeptoren (FcγR, FcR) aufheben und damit die Effektor-Funktion der Antikörper-gerichteten Zytotoxizität (ADCC) aufheben.
Unsere Fc Silent™-Antikörper ermöglichen es Forschern daher, die Effektor-Funktion in vivo aufzuheben und den unspezifischen Hintergrund bei Färbemethoden zu reduzieren. In vivo profitieren die Antikörper von der langen Plasmahalbwertszeit (t1/2), die mit der Fc-Domäne assoziiert ist, ohne die zytolytischen Immuneffektormechanismen, die mit der Wildtyp-Fc-Domäne verbunden sind. In vitro können die Antikörper für Anwendungen in der Durchflusszytometrie und Immunhistochemie (IHC) eingesetzt werden, um unspezifische Hintergrundsignale zu reduzieren, die aus der Bindung an den Fc-Rezeptor resultieren. Die Fc Silent™-Mutationen haben keinen Einfluss auf andere Eigenschaften des Antikörpers, einschließlich der Kompatibilität mit Sekundärantikörpern.
Alle Absolute Antibody-Antikörper und Fusionsproteine sind mit der Fc Silent™-Domäne erhältlich. Unser Reagenzienkatalog enthält speziesspezifische Fc Silent™-Domänen, wie z. B. für Mensch, Maus, Kaninchen, Ratte und Hamster, die wir auf Lager haben und sofort liefern können. Wenn Sie Ihren Wunsch-Antikörper nicht im Fc Silent™-Format sehen, kontaktieren Sie uns – wir stellen ihn gerne für Sie her!
Wenn Sie mehr über den Einfluss von Fc-Rezeptoren auf die Effektor-Funktion oder Fc-Engineering-Bestrebungen erfahren möchten, besuchen Sie unsere Antibody Resource, eine kostenlose Online-Referenzquelle für Forscher.
Fc Silent™ Bindungsdaten
Die Isotypen Maus IgG2a und Ratte IgG2b binden bekanntermaßen stark an Fc-Rezeptoren, unabhängig von der Spezifität des Testantikörpers. Isotyp-Kontrollen werden eingesetzt, damit der Forscher zwischen spezifischen und unspezifischen Hintergrundsignalen unterscheiden kann. In Abbildung 1 zeigen wir, wie murine Makrophagen durch eine Ratten-IgG2b-Isotypkontrolle fast genauso stark markiert werden wie durch einen Anti-F4/80. Der Wechsel zu Fc Silent™-Antikörpern führt zu zuverlässigen Daten mit einer Hintergrundfärbung, die von einer reinen Sekundärantikörper-Kontrolle nicht zu unterscheiden ist. Dies zeigt auch, dass Fc Silent™-Antikörper mit Standard-Sekundärantikörpern kompatibel sind.
Abbildung 2 zeigt anhand von Oberflächenplasmonenresonanz (SPR) und direktem kompetitivem Inhibitions-ELISA, dass das Fc Silent™-Format nicht mit murinen oder humanen Fc-Rezeptoren interagiert. Diese Daten wurden von Dr. Stephen Beers von der University of Southampton zur Verfügung gestellt.
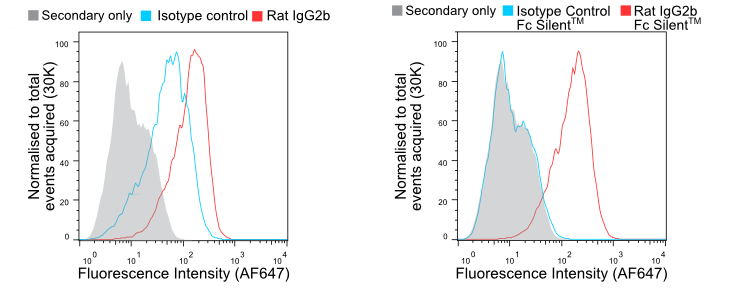
Abbildung 1. Durchflusszytometrie von BMDMs, gefärbt mit Wildtyp (A) und Fc Silent™ (B) anti-F4/80 (Ab00106-8.1 und Ab00106-8.4) und Isotyp-Kontroll-Antikörpern, gefolgt von fluoreszenzkonjugiertem Ziegen-Anti-Ratten-Sekundärantikörper. Durch die Verwendung von Fc Silent™ wird die unspezifische FcγR-getriebene Färbung eliminiert, wodurch die Daten sauberer und genauer werden. Klicken Sie hier für weitere Informationen.
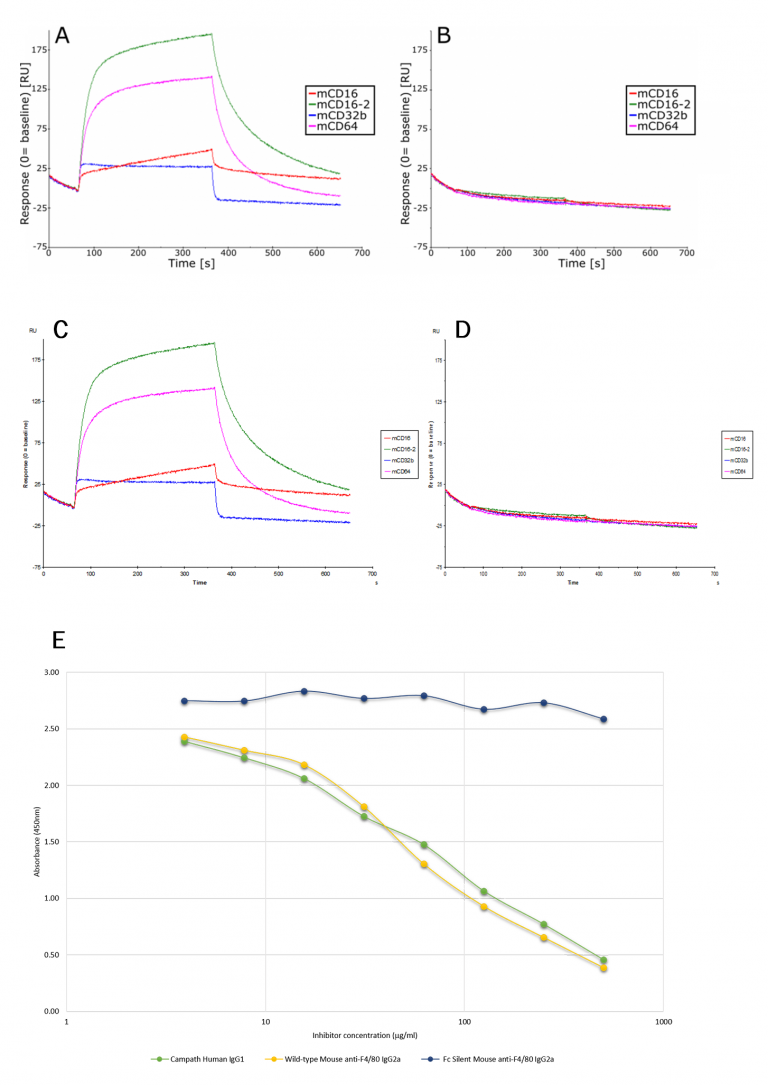
Abbildung 2A und B. Sensogramm, das die Bindung von Maus-Wildtyp- und Fc Silent™ anti-F4/80 IgG2a monoklonalen Antikörpern (Ab00106-2.0 bzw. Ab00106-2.3) an immobilisierte Maus-Fcγ-Rezeptoren mit niedriger und hoher Affinität (CD16, CD16-2, CD32, CD64). Die Biacore SPR-Bindungsanalyse zeigt, dass der Fc Silent™-Antikörper seine Fähigkeit verloren hat, mit den Maus-Fc-Rezeptoren zu interagieren.
Abbildung 2C und D. Sensogramm, das die Bindung der monoklonalen Ratten-Wildtyp- und Fc Silent™-Anti-F4/80-Antikörper (Ab00106-8.1 bzw. Ab00106-8.4) an immobilisierte Maus-Fcγ-Rezeptoren mit niedriger und hoher Affinität (CD16, CD16-2, CD32, CD64) zeigt. Die Biacore SPR-Bindungsanalyse zeigt, dass der Fc Silent™-Antikörper seine Fähigkeit zur Interaktion mit den Maus-Fc-Rezeptoren verloren hat.
Abbildung 2E. Direkter kompetitiver Inhibitions-ELISA. 2µg/ml/Vertiefung des humanen rekombinanten FcγR1-Rezeptors (rCD64) wurden auf eine 96-Well-Platte aufgetragen. 40µg/ml biotinyliertes Alemtuzumab (Campath) wurde mit unmarkierten seriell verdünnten murinen Wildtyp- oder Fc Silent™ anti-F4/80 IgG2a monoklonalen Antikörpern (Ab00106-2.0 bzw. Ab00106-2.3) oder Alemtuzumab (Campath; positive Kontrolle) vorgemischt. Die Daten zeigen deutlich, dass der Fc Silent™-Antikörper, Ab00106-2.3, nicht an den menschlichen Fc-Rezeptor bindet.