US Pharm. 2017;42(12):HS2-HS6.
ABSTRACT: Diarrhoe ist häufig das aufschlussreiche Symptom bei Patienten, die an einem Karzinoid-Syndrom als Folge eines Karzinoid-Tumors leiden. Als Ätiologie dieser belastenden Diarrhoe wird eine Hypersekretion von Serotonin aus neuroendokrinen Zellen vermutet. Die Diagnose wird anhand der klinischen Symptome und zweier Biomarker, 5-Hydroxyindolessigsäure (im Urin) und Chromogranin A (im Serum), gestellt. Synthetische Somatostatin-Analoga (SSAs) sind seit Jahren ein Grundpfeiler der Therapie und werden auch weiterhin eingesetzt. Telotristat ist das erste orale Medikament, das in Kombination mit SSAs für Patienten mit Karzinoid-Syndrom-Durchfall angezeigt ist, die nicht mehr auf SSAs allein ansprechen.
Neuroendokrine Tumore (NETs) umfassen eine große Vielfalt langsam wachsender Tumore. Die Inzidenz in den USA liegt zwischen zwei und fünf pro 100.000 Patienten und scheint anzusteigen, wahrscheinlich aufgrund besserer Screening-Methoden.1 Obwohl diese Tumore im Allgemeinen asymptomatisch sind, treten Symptome eher auf, wenn ein Tumor in die Leber oder Lunge metastasiert oder wenn der Primärtumor aus dem Mitteldarm stammt – d.h., Dünndarm, Blinddarm oder proximaler Dickdarm.2,3
Karzinoide Tumore und Karzinoid-Syndrom
Karzinoide Tumore sind NETs, die hauptsächlich aus enterochromaffinen Zellen entstehen, die sich im gesamten Gastrointestinaltrakt (GI) und den Bronchien befinden.1,2 Diese Zellen sind für die Produktion, Speicherung und Sekretion vieler biologisch aktiver Substanzen verantwortlich – darunter Serotonin, Noradrenalin, Dopamin, Histamin, Bradykinin, Prostaglandine, Substanz P und andere -, die zur Entwicklung des Karzinoid-Syndroms führen können, einem Sammelbegriff, der eine Vielzahl von Symptomen umfasst, die durch die vom Karzinoid-Tumor ausgeschütteten Hormone vermittelt werden.1-4
Ein gut differenziertes NET exprimiert zahlreiche Somatostatinrezeptoren (SSTRs).1 Von den fünf Typen von SSTRs werden SSTR1 und SSTR5 von synthetischen Somatostatinanaloga (SSAs) angesprochen. Karzinoidtumoren überexkretieren Serotonin, wodurch endogenes Tryptophan verbraucht wird. Eine normale Zelle wandelt nur 1 % des Tryptophans in Serotonin um, während eine Karzinoid-Tumorzelle Serotonin produziert, bis die Tryptophan-Vorräte aufgebraucht sind.3 Tryptophan ist eine Vorstufe von Niacin, das ein wesentlicher Bestandteil von Nicotinamid und Nicotinamid-Adenin-Dinucleotid/Nicotinamid-Adenin-Dinucleotid-Phosphat sowie der Proteinsynthese ist.3
Die häufigsten Symptome des Karzinoid-Syndroms sind Flush, Diarrhö, Tachykardie, Bronchospasmus und Kurzatmigkeit. Hämodynamische Instabilität kann ebenfalls auftreten, obwohl dies mit den derzeitigen Therapien selten ist.5 Patienten mit einem langfristigen unkontrollierten Karzinoid-Syndrom können Pellagra, Herzklappenläsionen, venöse Teleangiektasien und/oder Bronchospasmen entwickeln.2 Weniger als 10 % der Patienten mit GI-Karzinoid-Tumoren entwickeln ein Karzinoid-Syndrom, und die meisten von denen, die dies tun, haben Lebermetastasen.2
Durchfall beim Karzinoid-Syndrom
Durchfall tritt bei 80 % der Patienten mit Karzinoid-Syndrom auf.6 Patienten mit Durchfall beim Karzinoid-Syndrom haben mehrmals am Tag explosiven, wässrigen, lockeren Stuhlgang, was für den Patienten belastend und für das medizinische Personal eine Herausforderung sein kann. In einer Kohortenstudie wurde festgestellt, dass die Gesundheitskosten bei Patienten mit Karzinoid-Syndrom-Durchfall um das 1,5-fache und das Risiko eines Krankenhausaufenthalts um das 2-fache höher sind als bei Patienten ohne Durchfall.7 Die Pathophysiologie des Karzinoid-Syndrom-Durchfalls beinhaltet das Vorhandensein von überschüssigem Serotonin, das die Sekretion von Kolonschleim stimuliert, die Peristaltik erhöht und die Absorption im GI-Trakt hemmt – all dies führt zu Durchfall.3,4,6 Im Vergleich zu gesunden Patienten kann die proximale Kolontransitzeit bis zu sechsmal schneller und die Dünndarmtransitzeit doppelt so schnell sein bei Patienten mit Karzinoid-Syndrom-Diarrhoe.6
Risikofaktoren
Es wird angenommen, dass sich Nets sporadisch oder bei genetisch prädisponierten Personen entwickeln.3 Wenn ein Verwandter ersten Grades ein NET hat, liegt die Wahrscheinlichkeit, ein NET zu entwickeln, bei 12,5 pro 100.000 Personen und 15,7 pro 100.000 Personen für Männer bzw. Frauen.7 Andere assoziierte Erkrankungen, die in einer retrospektiven Untersuchung von 36 Patienten mit Karzinoid-Syndrom-Diarrhö berichtet wurden, sind atrophische Gastritis (67 %), perniziöse Anämie (58 %), Hypothyreose (39 %), Diabetes (19 %), Nebennierenrindeninsuffizienz (6 %) und Hyperparathyreoidismus (6 %).8 Laut einer prospektiven Untersuchung von 494.000 Probanden, die an der NIH-AARP Diet and Health Study teilnahmen und 8 Jahre lang beobachtet wurden, ist die Aufnahme von gesättigten Fetten mit einem erhöhten Risiko für die Entwicklung von Karzinoidtumoren verbunden.9 Die Zufuhr von Fleisch und Fett wurde anhand von Fragebögen zur Häufigkeit des Verzehrs geschätzt. Das Risiko für karzinoide Tumoren des Dünndarms war mit einer hohen Aufnahme von gesättigten Fetten im Vergleich zu einer niedrigen Aufnahme von gesättigten Fetten assoziiert (Hazard Ratio 3,18; 95% CI, 1,62-6,25).9 Wenn ein Patient Durchfall beim Karzinoidsyndrom hat, können Ernährung und Stress die Symptome beeinflussen. Patienten sollten auslösende Faktoren wie tyrosinhaltige Lebensmittel (gereifter Käse, fermentiertes Fleisch und Fisch, eingelegte Lebensmittel, Tofu, Schokolade), Alkohol und Erhöhungen von Katecholaminen (Sport, Anstrengung) vermeiden.1,2
Diagnose
Die Diagnose des Karzinoid-Syndroms basiert auf den Symptomen Durchfall und Flush in Kombination mit objektiven Befunden eines Karzinoid-Tumors durch Biopsie, Mehrphasen-CT des Abdomens/Beckens, MRT oder Biomarker.10 Die Biomarker 5-Hydroxyindolessigsäure (5-HIAA; wird im Urin gefunden) und Chromogranin A (CgA; wird im Serum gefunden) haben eine akzeptable Spezifität und Sensitivität für karzinoide Tumore.10,11 Serotonin wird durch Monoaminoxidase zu 5-HIAA metabolisiert, und CgA wird von den Wänden der Vesikel freigesetzt, die Serotonin speichern. Normale 5-HIAA-Spiegel im Urin liegen zwischen 3 und 15 mg/24 h; ein erhöhter Spiegel hat eine Spezifität von 100 % und eine Sensitivität von 73 % für Karzinoidtumoren.11 Die CgA-Spiegel im Serum korrelieren tendenziell mit der Tumorgröße, nicht aber mit den Symptomen. CgA-Spiegel über 130 mcg/L sind mit einer Spezifität von 98,4 % und einer Sensitivität von 62,9 % für Karzinoid-Tumoren assoziiert.11 Die Patienten sollten 48 Stunden vor der Urinsammlung serotoninreiche Lebensmittel meiden. Der Urinspiegel von 5-HIAA kann durch Levodopa fälschlicherweise gesenkt werden, während der Serum-CgA-Spiegel durch Protonenpumpenhemmer, Niereninsuffizienz oder entzündliche Zustände fälschlicherweise erhöht werden kann.10-13
Behandlung
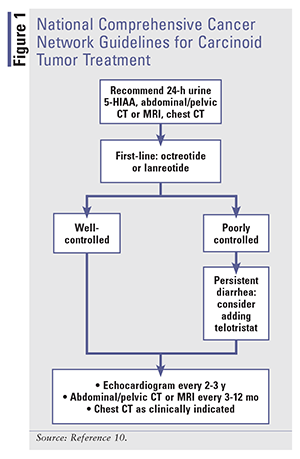
Die Behandlungsmodalitäten für Karzinoid-Syndrom-Diarrhoe konzentrieren sich auf die Verbesserung der Symptome und die Modifizierung der Krankheit selbst, was durch die Normalisierung der Biomarker belegt wird.11 SSAs sind die Hauptstütze der Therapie für Karzinoid-Tumoren. Somatostatin beeinflusst mehrere GI-Funktionen, einschließlich der GI-Motilität, der Sekretion von Pankreas- und Darmhormonen sowie der Sekretion von Galle und Kolonflüssigkeit.13 Wenn Somatostatin an Rezeptoren bindet, hemmt es die Sekretion biologischer Mediatoren, was durch die Senkung von Serotonin zu einer drastischen Verbesserung von Flush und Diarrhö führt, wie die Verringerung von 5-HIAA im Urin zeigt.13 Eine Tumorregression wird auch mit SSAs beobachtet.12,14,15 Siehe ABBILDUNG 1 für die Richtlinien des National Comprehensive Cancer Network (NCCN) zur Behandlung von Karzinoidtumoren.
Somatostatin-Analoga: Die SSAs Octreotid und Lanreotid bieten eine hormonelle Kontrolle bei Patienten mit Karzinoidtumoren.16,17 Kurz wirksames (SA) Octreotid war das erste SSA, das für die Kontrolle von Symptomen im Zusammenhang mit Karzinoidtumoren zugelassen wurde.16,18 Leider ist bei einer Halbwertszeit von 2 Stunden eine wiederholte Dosierung erforderlich. Octreotid mit langer Wirkstofffreisetzung (LA) sorgt für anhaltende Wirkstoffspiegel und wird monatlich als IM verabreicht.15 Studien, die die SA- und LA-Formulierungen verglichen, haben eine ähnliche Wirksamkeit hinsichtlich der Symptomkontrolle gezeigt, mit Ansprechraten von 60 % bis 72 %.18
Lanreotid ist als Formulierung mit verlängerter Wirkstofffreisetzung (Somatuline Depot) erhältlich, die alle 4 Wochen durch tiefe SC-Injektion verabreicht wird.17,18 SA-Octreotid und LA-Lanreotid haben eine ähnliche Wirksamkeit bei der Linderung von Symptomen.16 In einer klinischen Phase-III-Studie wurde der Einsatz von SA-Octreotid SC zur Kontrolle von Symptomen im Zusammenhang mit dem Karzinoid-Syndrom bei Patienten untersucht, die 16 Wochen lang alle 4 Wochen Lanreotid 120 mg SC (n = 59) oder Placebo (n = 56) erhielten.19 Der Prozentsatz der Tage mit Octreotid als Notfallmedikation war bei Lanreotid-Patienten signifikant niedriger (33,7 %; 95 % KI, 25 %-42,4 %) als bei Placebo-Patienten (48,5 %; 95 % KI, 39,6 %-57,4 %, P = .016).
Pasireotid (Signifor) bindet an SSTR1 und SSTR5 mit einer höheren Affinität als Octreotid und Lanreotid.16 In einer klinischen Studie der Phase II zeigte es Wirksamkeit bei Patienten mit fortgeschrittenen NETs und Karzinoid-Syndrom, die nicht mehr auf Octreotid ansprachen.20 Pasireotid long-acting release (LAR), das von der FDA nur für Akromegalie und Cushing-Syndrom zugelassen ist, zeigte eine ähnliche Wirksamkeit bei der Kontrolle der Symptome des Karzinoid-Syndroms im Vergleich zu hochdosiertem Octreotid LAR und führte in einer Phase-III-Studie aus dem Jahr 2015 zu einem verbesserten progressionsfreien Überleben bei Patienten, die refraktär auf SSAs reagierten.21,22
Wenn die Symptomkontrolle das Ziel ist, beginnt die Therapie mit SA-Octreotid. Da es bis zu 3 Wochen dauern kann, bis LA-Präparate Steady-State-Spiegel erreichen, kann die Symptomkontrolle mit SA-Octreotid erfolgen.15,18 Die Dosierung wird niedrig begonnen (100-600 mcg täglich in 2-4 Dosen) und auf die niedrigste wirksame Dosis titriert, die zur Kontrolle der Symptome notwendig ist. LA-Octreotid beginnt mit 20 mg IM intragluteal alle 4 Wochen, wobei SA-Octreotid mindestens 2 Wochen lang gleichzeitig gegeben wird. Siehe TABELLE 1 für Dosierung, unerwünschte Ereignisse und mögliche Wechselwirkungen mit anderen Medikamenten.
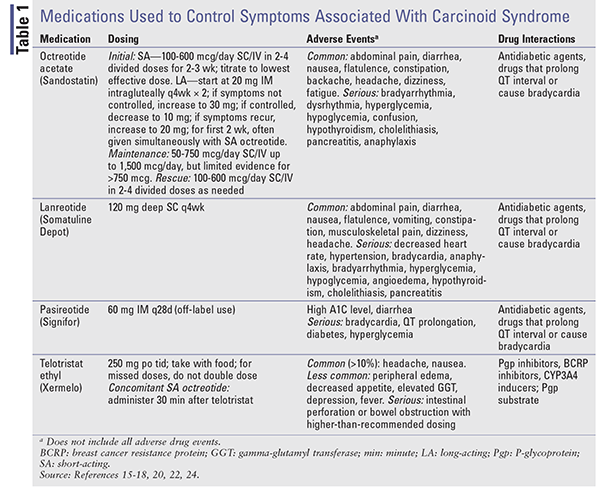
Telotristat Ethyl: Telotristat Ethyl (Xermelo), ein Prodrug von Telotristat, hemmt das Enzym Tryptophanhydroxylase, was zu einem verminderten peripheren Serotonin führt. Es ist von der FDA für die Behandlung der Diarrhoe beim Karzinoid-Syndrom in Kombination mit der SSA-Therapie bei Patienten zugelassen, die mit der SSA-Therapie allein nur unzureichend kontrolliert werden.23,24 In einer prospektiven, randomisierten Phase-III-Studie erhielten 135 Patienten, die trotz stabiler SSA-Dosierung täglich vier oder mehr Stuhlgänge hatten, 12 Wochen lang Telotristat 250 mg dreimal täglich, Telotristat 500 mg dreimal täglich oder Placebo.25 Die mittlere tägliche Stuhlgangshäufigkeitsreduktion unter Placebo, Telotristat 250 mg und Telotristat 500 mg betrug -0,9, -1,7 bzw. -2,1. Telotristat ist mit einem durchschnittlichen Großhandelspreis von 6.196,80 $ für vierundachtzig 250-mg-Tabletten kostspielig.23
Andere Wirkstoffe: Die Diarrhoe beim Karzinoid-Syndrom wird mit SSAs behandelt, und Telotristat wird hinzugefügt, wenn die Symptome unkontrolliert bleiben. Ein positives Ansprechen auf Chemotherapeutika, die das zugrunde liegende NET behandeln und dadurch die Tumoraktivität reduzieren, kann die Symptome des Karzinoid-Syndroms lindern. Es würde den Rahmen dieses Artikels sprengen, diese chemotherapeutischen Wirkstoffe zu besprechen. Wenn die Krankheit nach dem Einsatz von Octreotid oder Lanreotid fortschreitet, empfiehlt das NCCN den Einsatz von Everolimus, Interferon alfa-2b oder die zytotoxischen Chemotherapeutika 5-Fluorouracil, Capecitabin, Dacarbazin, Oxaliplatin, Streptozocin oder Temozolomid bei inoperablen und/oder metastasierten NETs des GI-Trakts.10
Schlussfolgerung
Die Inzidenz von karzinoiden Tumoren, einer Art von NET, nimmt zu. Es gibt keine bekannten Risikofaktoren für die Entwicklung von NETs oder Faktoren, die identifizieren können, welche Patienten ein Karzinoid-Syndrom entwickeln werden, obwohl die meisten Patienten mit Karzinoid-Syndrom zu Beginn oft Lebermetastasen haben. Das Karzinoid-Syndrom beschreibt eine Gruppe von Symptomen, die durch verschiedene Hormone vermittelt werden, die von einem Karzinoid-Tumor freigesetzt werden. Das Karzinoid-Syndrom tritt nicht bei allen Patienten mit Karzinoid-Tumoren auf. Der Durchfall beim Karzinoid-Syndrom kann explosiv sein und mehrmals am Tag auftreten. SSAs sind die Hauptstütze der Therapie zur symptomatischen Linderung der Diarrhö sekundär zu Karzinoid-Tumoren, und neue Therapien, wie Telotristat zusätzlich zur SSA-Therapie, bieten Optionen für Patienten, deren Symptome unerträglich sind.
1. Cives M, Soares HP, Strosberg J. Wird die klinische Heterogenität neuroendokriner Tumoren deren Management in Zukunft beeinflussen? Lessons from recent trials. Curr Opin Oncol. 2016;28:359-366.
2. Robertson RG, Geiger WJ, Davis NB. Carcinoid Tumors. Am Fam Physician. 2006;74:429-434.
3. Lips CJ, Lentjes EG, Höppener JW. Das Spektrum der karzinoiden Tumoren und karzinoiden Syndrome. Ann Clin Biochem. 2003;40:612-627.
4. Bertrand PP, Bertrand RL. Serotonin-Freisetzung und -Aufnahme im Gastrointestinaltrakt. Auton Neurosci. 2010;153:47-57.
5. Yao JC, Hassan M, Phan A, et al. One hundred years after „carcinoid“: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26:3063-3072.
6. von der Ohe MR, Camilleri M, Kvols LK, Thomforde GM. Motorische Dysfunktion des Dünn- und Dickdarms bei Patienten mit Karzinoid-Syndrom und Diarrhöe. N Engl J Med. 1993;329:1073-1078.
7. Babovic-Vuksanovic D, Constantinou CL, Rubin J, et al. Familial occurrence of carcinoid tumors and association with other malignant neoplasms. Cancer Epidemiol Biomarkers Prev. 1999;8:715-719.
8. Gough DB, Thompson GB, Crotty TB, et al. Diverse clinical and pathologic features of gastric carcinoid and the relevance of hypergastrinemia. World J Surg. 1994;18:473-479.
9. Cross A, Leitzmann MF, Subar AF, et al. A prospective study of meat and fat intake in relation to small intestinal cancer. Cancer Res. 2008;68:9274-9279.
10. National Comprehensive Cancer Network. NCCN-Leitlinien für die klinische Praxis in der Onkologie (NCCN-Leitlinien®): Neuroendokrine Tumoren. Version 3.2017. www.nccn.org/professionals/physician_gls/PDF/neuroendocrine.pdf. Accessed October 11, 2017.
11. Maroun J, Kocha W, Kvols L, et al. Guidelines for the diagnosis and management of carcinoid tumours. Part 1: the gastrointestinal tract. Eine Stellungnahme einer kanadischen nationalen Karzinoid-Expertengruppe. Curr Oncol. 2006;13:67-76.
12. Eriksson B, Oberg K, Stridsberg M. Tumormarker bei neuroendokrinen Tumoren. Digestion. 2000;62(suppl 1):33-38.
13. van der Lely AJ, de Herder WW. Karzinoid-Syndrom: Diagnose und medizinisches Management. Arq Bras Endocrinol Metabol. 2005;49:850-860.
14. Cives M, Strosberg J. Behandlungsstrategien bei metastasierten neuroendokrinen Tumoren des Gastrointestinaltrakts. Curr Treat Options Oncol. 2017;18:14.
15. Enzler T, Fojo T. Langwirksame Somatostatinanaloga in der Behandlung von inoperablen/metastasierten neuroendokrinen Tumoren. Semin Oncol. 2017;44:141-156.
16. Octreotid. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Accessed October 11, 2017.
17. Lanreotide. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Accessed October 11, 2017.
18. Narayanan S, Kunz PL. Rolle von Somatostatin-Analoga in der Behandlung von neuroendokrinen Tumoren. Hematol Oncol Clin N Am. 2016;30:163-177.
19. Vinik AI, Wolin EM, Liyanage N, et al. Evaluation of lanreotide depot/autogel efficacy and safety as a carcinoid syndrome treatment (ELECT): a randomized, double-blind, placebo-controlled trial. Endocr Pract. 2016;22:1068-1080.
20. Kvols LK, Oberg KE, O’Dorisio TM, et al. Pasireotid (SOM230) zeigt Wirksamkeit und Verträglichkeit bei der Behandlung von Patienten mit fortgeschrittenen neuroendokrinen Tumoren, die refraktär oder resistent gegenüber Octreotid LAR sind: Ergebnisse einer Phase-II-Studie. Endocr Relat Cancer. 2012;19:657-666.
21. Wolin EM, Jarzab B, Eriksson B, et al. Phase-III-Studie von Pasireotid mit langwirksamer Freisetzung bei Patienten mit metastasierten neuroendokrinen Tumoren und Karzinoid-Symptomen, die refraktär gegenüber verfügbaren Somatostatin-Analoga sind. Drug Des Devel Ther. 2015;9:5075-5086.
22. Pasireotide. Micromedex Solutions. Greenwood Village, CO: Truven Health Analytics. www.micromedexsolutions.com. Accessed October 23, 2017.
23. Markham A. Telotristat ethyl: first global approval. Drugs. 2017;77:793-798.
24. Telotristat. Lexicomp Online. Hudson, OH: Lexi-Comp, Inc; 2017. http://online.lexi.com. Accessed October 11, 2017.
25. Kulke MH, Hörsch D, Caplin ME, et al. Telotristat ethyl, a tryptophan hydroxylase inhibitor for the treatment of carcinoid syndrome. J Clin Oncol. 2017;35:14-23.