Lackmuspapier ist das bekannteste Mitglied der chemischen Indikatoren. Wie die meisten pH-Papiere ändert Lackmus die Farbe, wenn es einer sauren oder basischen Lösung ausgesetzt wird. Die einfache pH-Skala reicht von 0-14, wobei 0 der sauerste, 7 der neutralste und 14 der basischste oder alkalischste Wert ist. Lackmuspapier wird häufig im naturwissenschaftlichen Unterricht verwendet. Da es einen so hohen Bekanntheitsgrad hat, ist es auch zu einer kulturellen Referenz in unserer Gesellschaft geworden. Es ist üblich, den Begriff Lackmustest zu verwenden, wenn man sich auf einen Test bezieht, bei dem ein einzelner Faktor das Ergebnis bestimmt.
Hintergrund
Mit Lackmuspapier kann ein Beobachter den pH-Wert einer Probe bestimmen. Der pH-Wert ist eine Möglichkeit, die relative saure oder basische Natur einer Substanz anhand ihrer Wasserstoffionenkonzentration zu charakterisieren. Ein Ion ist ein Atom, das eine elektrische Ladung trägt und daher mit seiner Umgebung reaktiv ist. Eine saure Substanz gibt in Wasser Wasserstoffionen (H+) ab. Säuren sind als Protonendonatoren bekannt, weil das H+-Ion ein zusätzliches positiv geladenes Proton hat, das versucht, sich durch die Verbindung mit einem negativ geladenen Ion zu stabilisieren. Eine basische Substanz gibt in Wasser ein Hydroxid-Ion (OH-) ab. Basen werden Protonenakzeptoren genannt, weil das Hydroxid-Ion ein Proton annimmt, um sich selbst zu stabilisieren. Interessanterweise ist das Ergebnis, wenn Säuren und Basen kombiniert werden, ein neutrales Salz. Zum Beispiel führt eine starke Säure wie Salzsäure in Kombination mit Natriumhydroxid (einer starken Base) zu einer Neutralisationsreaktion mit den Nebenprodukten Natriumchlorid (Kochsalz) und Wasser.
Der pH-Wert ist ein wichtiger biologischer Indikator, da die meisten Lebensformen einen sehr kleinen pH-Bereich haben, in dem sie überleben können. Zum Beispiel ist das Säure-Basen-Verhältnis im menschlichen Körper ein empfindliches Gleichgewicht. Schon eine geringe Veränderung des pH-Wertes im Blut in die eine oder andere Richtung kann zum Tod führen. Auch Pflanzen reagieren empfindlich auf kleinste pH-Veränderungen im Boden. Deshalb wird Erde, die für eine Pflanze zu sauer ist, mit Calciumcarbonat-Dünger, einer Base, neutralisiert.
Die einfache pH-Skala reicht von 0-14, wobei 7 neutral ist. Zahlen kleiner als 7 gelten als sauer und Zahlen größer als 7 als basisch. Je kleiner die Zahl, desto saurer ist die Lösung. Das bedeutet, dass eine Substanz mit einem pH-Wert von 1 eine größere Fähigkeit hat, ein Proton an ein anderes Molekül oder Ion abzugeben, als eine Substanz mit einem pH-Wert von 4. Zum Beispiel ist Schwefelsäure sehr effektiv bei der Übertragung eines Hydroxid-Ions, während Essigsäure (Essig) dies nicht ist. Daher gilt Schwefelsäure als starke Säure und Essigsäure als schwache Säure. In ähnlicher Weise gibt es auch starke und schwache Basen. Eine starke Base wie Kaliumhydroxid mit seinen reichlich vorhandenen Hydroxidionen nimmt leichter Protonen auf als eine schwache Base wie Ammoniak. Je größer die Anzahl, desto stärker ist die Base.
Während Lackmuspapier effektiv anzeigt, ob eine Substanz sauer oder basisch ist, kann es keinen genauen numerischen pH-Wert angeben. Zu diesem Zweck werden Universalindikatoren oder pH-Meter verwendet. Universalindikatoren bestehen aus verschiedenen Materialien, die bei unterschiedlichen pH-Werten unterschiedliche Farben annehmen, wodurch der Beobachter genauer bestimmen kann, wo die betreffende Lösung auf der pH-Skala liegt. Universalindikatoren können auf Papier imprägniert und zu pH-Papier verarbeitet werden oder sie können in flüssiger Form verwendet werden. Jedem Universalindikator liegt eine Referenzfarbkarte bei, die eine bestimmte Farbe mit einem pH-Bereich korreliert. Im Allgemeinen sind die meisten Universalindikatoren bis auf zwei Werte auf der pH-Skala genau. Zum Beispiel könnte ein grünes Ergebnis einen pH-Wert von 8-9 anzeigen. Das bedeutet, dass Universalindikatoren den pH-Wert einer Probe quantitativ innerhalb eines bestimmten Bereichs bestimmen können.
PH-Meter ermöglichen eine noch genauere Quantifizierung, indem sie Elektrizität verwenden, um einen numerischen pH-Wert zu bestimmen. Eine Sonde wird in die Probe gesteckt und ein elektrischer Strom fließt durch die Sonde. Da Strom aus Elektronen besteht, die eine negative Ladung haben, ist die Stärke des Stroms, der durch das Messgerät fließt, direkt proportional zur Wasserstoffionenkonzentration. Je mehr H+-Ionen in der Lösung sind, desto mehr Strom fließt durch das Messgerät. Diese Zahl wird dann in einen numerischen pH-Wert umgewandelt, der vom Betrachter abgelesen werden kann.
Geschichte
Der Begriff Lackmus kommt von einem altnordischen Wort, das „färben oder färben“ bedeutet. Dies ist passend, da die Flechten, die zur Herstellung von Lackmus verwendet werden, seit Hunderten von Jahren auch zum Färben von Stoffen genutzt werden. Über die Anfänge von Lackmus gibt es nur sehr wenige Informationen. Es gibt einige Daten, die darauf hindeuten, dass Lackmuspapier von J.L. Gay-Lussac, einem französischen Chemiker in den frühen 1800er Jahren, entwickelt wurde. Gay-Lussac ist vor allem für sein Gesetz der kombinierten Volumina bekannt, das besagt, dass immer dann, wenn sich Gase bilden oder bei konstanter Temperatur und konstantem Druck miteinander reagieren, ihre Volumina in kleinen ganzzahligen Verhältnissen stehen. Mit anderen Worten: Wenn sich Gase verbinden, tun sie dies immer auf die gleiche Weise, vorausgesetzt, die Temperatur und der Druck bleiben gleich.
Rohstoffe
Die Hauptrohstoffe für die Herstellung von Lackmuspapier sind Holzzellulose, Flechten und Hilfsstoffe. Lackmuspapier besteht, wie der Name schon sagt, hauptsächlich aus Papier. Das zur Herstellung von Lackmuspapier verwendete Papier muss frei von Verunreinigungen sein, die den pH-Wert des zu messenden Systems verändern könnten. Wie das meiste Papier wird auch Lackmuspapier aus Holzzellulose hergestellt. Das Holz wird vor der Papierherstellung mit Lösungsmitteln behandelt, um harziges Material und Lignin aus dem Holz zu entfernen. Eines der gebräuchlichsten Lösungsmittel in den Vereinigten Staaten ist ein Sulfat – entweder Natriumsulfat oder Magnesiumsulfat.
Die Fähigkeit des Lackmuspapiers, seine Farbe zu ändern, wenn es einer Säure oder Base ausgesetzt wird, ist ein Ergebnis der Durchtränkung von Lackmuspapier mit Flechten. In der Pflanzenwelt sind Flechten einzigartig, da sie eigentlich zwei verschiedene Organismen sind, ein Pilz und eine Alge, die als einer leben. Botaniker stufen Flechten als Pilze ein, weil es die Pilze sind, die für die sexuelle Fortpflanzung verantwortlich gemacht werden. Allerdings hat jede Flechte ihren eigenen, eindeutigen Namen. Ungefähr 15.000 verschiedene Arten von Flechten sind identifiziert worden. Flechten können auf Felsen, Bäumen und Mauern, im Boden und sogar unter Wasser in praktisch allen Klimazonen wachsen. Flechten werden häufig als Gradmesser für die Umweltqualität verwendet, da sie empfindlich auf verschiedene Schadstoffe reagieren. Mehrere Flechtenarten werden zur Herstellung von Lackmus verwendet, darunter die im Mittelmeerraum beheimatete Rocella tinctoria und die in den Niederlanden verbreitete Lecanora tartarea. In der Tat sind die Niederlande einer der größten Produzenten von Lackmuspapierprodukten.
Design
Die meisten Lackmuspapiere und andere Arten von pH-Indikatoren werden über wissenschaftliche Versorgungshäuser verkauft. Lackmuspapier ist sowohl in roten als auch in blauen Varianten erhältlich. Die natürliche Farbe für Lackmuspapier ist blau. Wenn es in eine saure Lösung gegeben wird, färbt sich das blaue Papier rot. Rotes Lackmuspapier wird bei der Herstellung zunächst mit einer Säure vermischt. Dies lässt das Papier rot erscheinen. Wenn es in eine Base gelegt wird, nimmt das Papier seine natürliche blaue Farbe wieder an.
Der Herstellungsprozess
Die Herstellung von Lackmuspapier hat viele Gemeinsamkeiten mit der Papierherstellung. In diesem Prozess wird der Zellstoff zu Papier verarbeitet, das Papier wird mit der Flechtenlösung getränkt und das Papier wird getrocknet und verpackt.
Holzstoff umwandeln
- 1 In diesem ersten Schritt wird Holz zerkleinert und unter Dampfdruck mit einem Lösungsmittel und Wasser vermischt. Die entstehende Masse wird als Holzstoff bezeichnet. Der Brei wird auf einem Band aus Drahtgewebe ausgebreitet und über Walzen geführt. Dabei entsteht
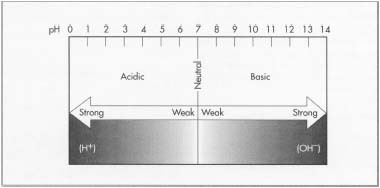 Die pH-Skala.
Die pH-Skala.eine dünne Schicht, die getrocknet und zu brauchbarem Papier verarbeitet werden kann. Ein Holzkasten unter dem Band fängt das ablaufende Wasser auf. Da sich in diesem Wasser noch verwertbare Fasern befinden, wird es wieder mit dem Zellstoff vermischt.
- 2 Um den Trocknungsprozess zu beschleunigen, werden Luftabsaugpumpen unterhalb des Bandes eingesetzt. Während sich das Papier entlang des Bandes bewegt, läuft es unter einem Sieb- oder Drahtzylinder, dem Egoutteur, hindurch. Der Zweck des Egoutteurs ist es, dem Papier ein Web- oder Wasserzeichen zu geben, das die Papiersorte und den Hersteller identifiziert. Das Papier setzt seine Reise auf dem Transportband fort, wo es zwischen zwei mit Filz bezogenen Walzen (Gautschwalzen) gepresst wird, die die Fasern durch Auspressen von zusätzlichem Wasser zum Zusammenbinden zwingen.
- 3 Von diesen Gautschwalzen wird das Papier durch zwei Sätze von glatten Metallpresswalzen geschoben, wodurch das Papier eine glatte Oberfläche erhält. Das Papier wird vollständig getrocknet, indem es beheizten Walzen ausgesetzt wird, von rotierenden Schneidemaschinen geschnitten und auf Rollen aufgewickelt wird.
Infusion von Flechten
- 4 Um das Papier pH-aktiv zu machen, wird es anschließend mit einer wässrigen Lösung infundiert, die hauptsächlich aus Flechten besteht. Dies geschieht, indem das Papier durch ein Bad der Lösung läuft. Es absorbiert die Lösung und wird dann weitergegeben, damit es gärt und trocknet.
- 5. Die Flechten werden in Gegenwart von Kaliumcarbonat und Ammoniak fermentieren gelassen. Nach der Gärung hat die Masse eine blaue Farbe und wird dann mit Kreide vermischt. Blaues Lackmuspapier wird hergestellt, indem man weißes Papier in einem Aufguss der oben genannten Lackmusmischung tränkt. Das Papier wird dann sorgfältig an der Luft getrocknet. Rotes Lackmus wird auf ähnliche Weise hergestellt, jedoch wird ein kleiner Prozentsatz an Schwefel- oder Salzsäure hinzugefügt, damit es sich rot färbt.
Verpackung
- 6 Nachdem das Papier aufbereitet ist, wird es zu einer Endverpackungsstation geschickt. Lackmuspapier wird normalerweise in vorgeschnittenen Streifen verkauft. Die Hersteller legen die Streifen in wiederverschließbare Plastikfläschchen. Es ist wichtig, dass die Verpackung verhindert, dass die Streifen mit Feuchtigkeit in Berührung kommen, da jede Flüssigkeit, die mit dem Lackmuspapier in Berührung kommt, eine Farbveränderung des Indikators verursachen könnte. Es ist möglich, wenn auch nicht so üblich, Lackmuspapier in Rollen zu kaufen, die vom Benutzer abgeschnitten werden können. Die Hersteller liefern mit jeder Packung Lackmuspapier auch eine schriftliche Anleitung, damit der Benutzer weiß, wie das Produkt richtig zu verwenden ist. Bei Universalindikatorpapieren oder -lösungen reicht eine schriftliche Anleitung nicht aus. Eine Farbreferenzkarte wird ebenfalls mitgeliefert, damit der Anwender das Testergebnis mit der Referenzkarte abgleichen kann, um den pH-Wert zu bestimmen.
Die Zukunft
Litmuspapier wird aufgrund seiner günstigen Kosten und seiner einfachen Handhabung sicherlich auch weiterhin häufig im Unterricht eingesetzt werden. Allerdings sterben einige Arten von Flechten aus. Daher ist es möglich, dass die Hersteller von Lackmuspapier in Zukunft auf synthetische Materialien umsteigen werden. Dies wird bereits von Herstellern anderer Arten von pH-Papieren getan. Da Lackmus außerdem keine quantitativen Ergebnisse liefern kann, kann es andere pH-Papiere und pH-Meter nicht ersetzen. Vielmehr geht der Trend dahin, pH-Indikatoren herzustellen, die noch genauer und weniger subjektiv sind. Ein solcher Trend ist die Verwendung von faseroptischen Sonden in pH-Metern, um sie noch empfindlicher zu machen.
Wo Sie mehr erfahren können
Bücher
Brady, George S. Materials Handbook. 14. Auflage. New York: McGraw Hill, 1997.
Daub, William G., und William S. Seese. Basic Chemistry. 7th Edition. Upper Saddle, NJ: Prentice Hall, 1996.
LaRoe, Edward T. Our Living Resources. Washington, DC: U.S. Department of Interior-National Biological Service, 1995.
„Lichen“. In Van Nostrand’s Scientific Encyclopedia. 8th Edition. New York: Douglas M. Considine, 1995.
Sonstiges
Botanical.com . http://www.botanical.com (Januar 2001).
Hanna Instruments Online. http://www.hannainst.com (Januar 2001).
Kiwi Web Chemistry and New Zealand. http://www.chemistry.co.nz (Januar 2001).
Precision Labs. 9889 Crescent Park Drive Westchester, OH. (513) 777-3034.
– Sandy Delisle und
Perry Romanowski