Einleitung
Seit der ersten klinischen Beschreibung der rheumatoiden Arthritis (RA) hat der Pannus eine Schlüsselrolle in der Entwicklung der Krankheit gespielt und sein Verständnis hat sich zusammen mit der Entwicklung von histologischen, molekularbiologischen und bildgebenden Techniken verbessert.
In der Klinik wurde der Pannus als späte, inaktive und irreversible Manifestation der Erkrankung angesehen, obwohl der Begriff rein histologisch ist. Die Verwirrung wird immer deutlicher, wenn es um die klinische Überwachung der RA und die Verwendung von Begriffen wie Pannus, Synovitis oder chronische Synovitis geht, mit einer verschwommenen Vorstellung über die Aktivität der Krankheit.
Für diese Übersichtsarbeit wurde eine Literaturrecherche in Pubmed und Embase mit den Begriffen Pannus, rheumatoid arthritis, ultrasonography, magnetic resonance von 1900 bis 2015 durchgeführt. Nicht-indizierte Texte und Bücher zum Thema wurden durchsucht, um eine narrative und historische Beschreibung über den Pannus, seine Entwicklung und seine pathologische Rolle bei der RA zu erstellen.
Die erste klinische und histologische Beschreibung des Pannus bei rheumatoider Arthritis
Obwohl ähnliche Begriffe wie RA bereits vor 1859 verwendet wurden, war es Garrod (Abb. 1), der in Kapitel XV seines Buches „The nature and treatment of gout and rheumaticgout „1,2 die Krankheit, wie wir sie heute kennen, genau beschrieb und sie von Gicht und rheumatischem Fieber abgrenzte. Er bot detaillierte Illustrationen (Abb. 2) der typischen Deformationen und unterstrich den ernsten Charakter der Krankheit im Vergleich zu anderen Zuständen, aufgrund der Schwierigkeit, die Krankheit zu kontrollieren und ihrer behindernden klinischen Entwicklung (Abb. 3).

Fotografie von Sir. Alfred Baring Garrod, 1819-1907.3
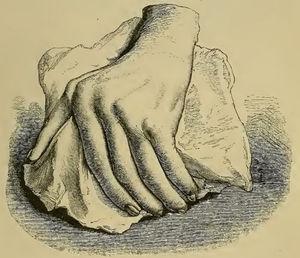
Abbildung aus Garrods Buch, die eine deformierte Hand mit Ulnardeviation als Folge einer rheumatoiden Arthritis zeigt.1,2
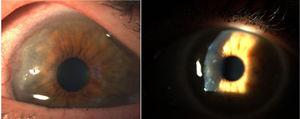
Hornhautpannus.8
Trotz einer sehr gründlichen klinischen Beschreibung der RA, versäumte Garrod die Gelenkbeteiligung aus histopathologischer Sicht zu erwähnen. Jahrzehnte später versuchte William Ord, Arzt am St. Thomas’s Hospital in London, in seinem 1880 im British Medical Journal veröffentlichten Manuskript, einige Zweifel an dem Begriff RA zu klären, der, wie er betonte, häufig unspezifisch zur Klassifizierung verschiedener Krankheiten verwendet wurde. Ord schlug vor, dass der Begriff RA nur für die Art der entzündlichen Gelenkbeteiligung mit Erguss verwendet werden sollte, die sich von Gicht, rheumatischem Fieber (Rheuma) oder Skrofulose unterscheidet und durch Knochen- und Knorpelatrophie sowie Synovialhypertrophie gekennzeichnet ist. Diese Aussage wies auf einen Zusammenhang mit der Pathophysiogenese der RA hin.4
In den Jahren 1905 und 1909 legten Nichols und Richardson in ihren Arbeiten, die im Journal of Medical Research bzw. im Boston Medical and Surgical Journal5 veröffentlicht wurden, eine der besten klinisch-pathologischen Beschreibungen rheumatischer Erkrankungen vor und unterschieden 2 Patientengruppen: eine, die die klinischen Merkmale ähnlich der RA aufweist, und die andere, die die Merkmale der Osteoarthritis zeigt.6 Ungeachtet der Tatsache, dass sich beide Artikel von Nichols und Richardson auf Fälle von nicht skrofulöser deformierender Arthritis beziehen, stellt die gründliche Darstellung der klinischen Manifestationen, begleitet von Bildern und Röntgenaufnahmen, eindeutig Fälle von RA dar. Diese Autoren stellten auch eine Reihe von histologischen Proben aus 75 klinischen Fällen zusammen und kamen zu einer wichtigen Schlussfolgerung: Es gibt 2 histologische Muster der Gelenkbeteiligung, eines der Verschlechterung des Gelenkknorpels und das andere der Verdickung der Synovialmembran. Letzteres ist eng mit der Invasion des Knochengewebes und des Gelenkknorpels verbunden, was zu einer Zerstörung und gelegentlich zu einer desorganisierten Knochenneubildung führt. In derselben Publikation von Nichols und Richardson wird eine proliferative Arthritis mit stark vaskularisierter Granulationsgewebsbildung beschrieben, mit einer Zellkomponente mesenchymalen Ursprungs, vor allem der Synovialmembran und des so genannten pannusartigen Gewebes. Dies ist das erste Mal, dass der Begriff Gelenkpannus verwendet wurde.5 Es sollte hervorgehoben werden, dass der Begriff Pannus zu dieser Zeit bereits in der Ophthalmologie verwendet wurde, um einige Arten von Hornhautläsionen zu beschreiben, und wurde von der American Academy of Ophthalmology als fibröses und vaskuläres Gewebewachstum zwischen dem Epithel und der Bowman-Membran definiert, das oft in Fällen von chronischem Hornhautödem nach einer Entzündung der Hornhaut vorhanden ist7 (Abb. 7). In beiden Fällen, Synovialpannus und Hornhautpannus, ähneln die beschriebenen Läsionen einem Pannus, dem lateinischen Wort für „Tuch“.
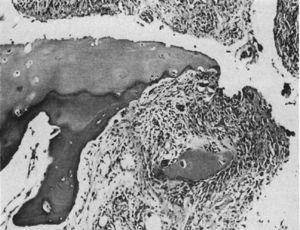
Lichtmikroskopische Histologie. Destruktive Läsion am Interphalangealgelenkrand. Neben dem Granulationsgewebe ist das Synovialgewebe bzw. der Pannus zu erkennen – die sogenannte Klammerbewegung, die ein mit „C“ gekennzeichnetes Knorpelfragment isoliert.9
Ein Teil der Bilder und Beschreibungen der Studie von Nichols und Richardson 19095 sind in Abb. 4-6.
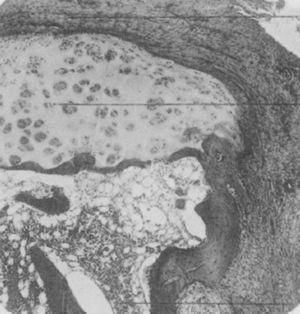
Lichtmikroskopische Aufnahme der distalen Phalanx eines Patienten, der an der damals als proliferative Arthritis vom Extremtyp bezeichneten Erkrankung leidet. Sie zeigt die Bildung von dickem Granulationsgewebe, das in den Gelenkknorpel eindringt und diesen zerstört.5,6
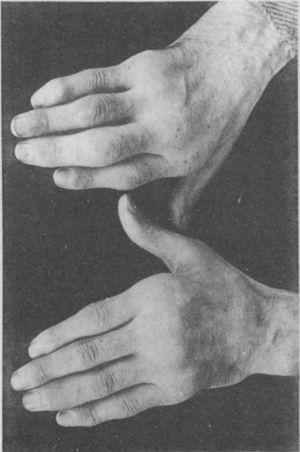
Aufnahme der Hände eines 35-jährigen Patienten mit einer Gonokokken-Urethritis in der Vorgeschichte, der Jahre später eine progressive Polyarthritis der kleinen und großen Gelenke entwickelte. Klassifiziert als proliferative Arthritis.5,6
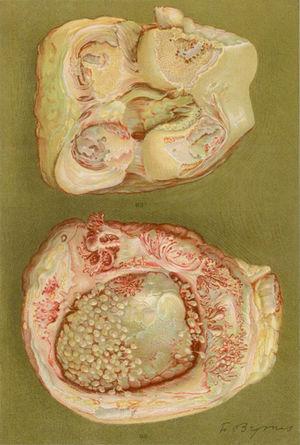
Zeichnung der Nekropsie einer 40-jährigen Frau mit einer Klinik der Polyarthritis der großen und kleinen Gelenke, die zu erheblichen Behinderungen und Ankylosen führt. Es gibt Hinweise auf einen Verlust der Gelenkknorpel und Knochenbildungszonen, die zu Knieankylosen führen.5,6
(0.25MB).
1959 veröffentlichte Kulka eine Übersicht über die Pathogenese der RA,9 wobei er sich auf die Arbeit von Nichols und Richardson5 berief, die die histologischen Läsionen bei RA in 3 Typen einteilte: Der erste Typ wurde als entzündliche Veränderungen der Synovialmembran klassifiziert, der zweite als Bindegewebsdegeneration und -nekrose und der dritte als vaskuläre entzündliche Infiltration der Arteriolen und Venolen. Der erste Typ von Läsionen entspricht dem 1909 von Nichols und Richardson beschriebenen Pannus, der aus einer synovialen Verdickung besteht, die eine Knorpelresorption verursacht. Kulka fand mit Hilfe der Lichtmikroskopie heraus, dass einerseits die destruktive Läsion des Knorpels durch die chronisch entzündete synoviale Gewebswucherung – oder Pannus – charakterisiert ist und andererseits das Granulationsgewebe, das aus den subchondralen Knochenmarkräumen wuchert und sich durch die subchondrale Platte hindurch ausbreitet, um sich an den Pannus anzuheften und ihn mit einer Klammerbewegung zu umgeben, zur Isolierung von Fragmenten des marginalen Knorpels fortschreiten kann (Abb. 7).9
Kulka definierte in seiner Arbeit die histologischen Kriterien, um eine RA zu diagnostizieren, wenn mindestens 3 der 5 charakteristischen Merkmale erfüllt sind, bei Fehlen einer anderen wahrscheinlichen Diagnose:
-
Villöse Proliferation
-
Proliferation der oberflächlichen Synovialzellen, in der Regel palisadierend
-
Markierte Infiltration von Entzündungszellen (Lymphozyten oder Plasmazellen) mit der Tendenz, lymphoide Knötchen zu entwickeln
-
Kompakte Fibrinablagerung
Obwohl betont wurde, dass keines dieser Merkmale spezifisch ist, war die Kombination von 3 oder mehr Merkmalen in Abwesenheit anderer Pathologien von erheblichem diagnostischem Wert für RA (Abb. 8).

Lichtmikroskopische Histologie. Klassische Kniesynovitis bei RA mit villöser Hypertrophie, vaskulärer Infiltration und lymphatischen Knötchen mit einem Keimzentrum in der rechten Ecke.9
Elektronenmikroskopie und Pannustumormodell
Im Jahr 1975 führten Kobayachi und Ziff10 elektronenmikroskopische Untersuchungen des Pannus und seiner Anhaftung am Knorpel durch, um zum Verständnis von Gelenkschäden beizutragen. Obwohl Ziff bereits 196011 Veränderungen der Synovialmembran beschrieben hatte, beschrieben die beiden Autoren, dass sich im Inneren des Pannus lysosomale Proteasen entwickeln könnten, die die Mucoproteine im Knorpel abbauen und an bestimmten Stellen, wie den Gelenkrändern, wo die initiale Pannusproduktion stattfindet, also an der Schnittstelle von Synovialmembran und Gelenkknorpel, sezerniert werden könnten.12
Diese Forscher analysierten Proben der Synovial-Knorpel-Grenzfläche bei 8 Patienten mit der Diagnose RA und identifizierten 3 Arten von Läsionen: die erste mit einer mononukleären Zellinfiltration der Gefäße, die in den Knorpel eindringt und gelegentlich Zellnester oder Aggregate innerhalb der Knorpelmatrix bildet (zusätzlich zu Plasmazellen, Lymphozyten und Granulozyten). Darüber hinaus wurde innerhalb dieser Nester auch gelöstes zirkulierendes Kollagen gefunden, was zur Theorie einer proteolytischen Enzymausschüttung führte (Abb. 9). Der zweite Typ von Läsionen entspricht einer direkten Invasion des Knorpels von monozytären Zellen und schlecht differenzierten Fibroblasten, die sich als phagozytär oder fibroblastisch manifestieren können, mit einem amorphen zytoplasmatischen granulären Inhalt mit Zellfortsätzen, die die knorpelige Kollagenmatrix abbauen und innerhalb der Zellfortsätze zu sehen sind (Abb. 10). Der dritte Läsionstyp stellt sich als dicke Schicht aus faserigem und vaskularisiertem Gewebe dar, das den Knorpel bedeckt und die normale Vaskularisierung des Gelenkknorpels beeinträchtigt.

Elektronenmikroskopische Aufnahme, die Fibroblasten mit eingetauchten Lysosomen (Lys) und mehreren zytoplasmatischen Fortsätzen zeigt, die in die Knorpelmatrix (Ctm) eindringen.10
In den nächsten 2 Jahrzehnten beschränkte sich die führende Rolle des Pannus in der Pathophysiologie der Gelenkerkrankung bei RA nicht nur auf die Beschreibung der Knorpelzerstörung. Edward Harris veröffentlichte 199013 eine der umfassendsten Übersichtsarbeiten zur Pathophysiologie der RA und klassifizierte sie in 5 Typen, entsprechend den immunologischen Merkmalen der Gelenkschädigung. Er beschrieb, dass in den Anfangsstadien (Stadium 2) die nicht verdickte Synovia und die zytokinvermittelte Neovaskularisation der Makrophagen14 mit Akkumulation der perivaskulären Lymphozyten eine Rolle spielen.15 Wie bereits von Kobayashi10 mit Hilfe der Elektronenmikroskopie gezeigt wurde, aktivieren Lymphozyten – meist T CD4+16 mit wenigen T-Regulatoren17 – die lokalen B-Lymphozyten, die zu Antikörper-produzierenden Plasmazellen im Synovialgewebe heranreifen,18 und kompromittieren dieses Gewebe als Teil des Beginns und Fortschreitens der Erkrankung. Harris behauptete auch, dass in fortgeschritteneren Stadien der Krankheit (Stadium 4) eine üppige Proliferation der Synovia mit bis zum 100-fachen ihres normalen Gewichts auftrat, was als tumorähnliches Verhalten mit erhöhter Zellaktivität der Synoviozyten interpretiert wurde, wie in angereichertem Kulturmedium bestätigt wurde, in dem die Zellen isoliert und autonom wuchsen,19 was dazu führte, erstmals das Modell der Onkogene in Betracht zu ziehen, wie es bei Krebs der Fall ist.
Pannuszellkomponenten
Obwohl mehrere Forscher die verdickte Gewebe- oder Pannuskomponente weiter untersuchten, wurde keine Einigung hinsichtlich ihrer Pathogenese erzielt. 1983 untersuchten Burmester et al.20 die nicht-lymphozytären Zellen des Pannus mittels monoklonaler Antikörper, die gegen Makrophagen- und Fibroblastenantigene gerichtet waren. Sie identifizierten 3 Typen von Synovia-Linien-Zellen; die ersten waren meist (40% der Gesamtmenge) monozytäre Zellen oder Makrophagen mit phagozytärer Fähigkeit, mit Fc-Rezeptoren und HLA DR-Expression oder Typ II. Der zweite Zelltyp war ähnlich wie Monozyten, aber nicht phagozytär, mit HLA-DR-Expression und keine anderen monozytären Antigene gefunden. Die letzte gefundene Zelllinie war positiv für Fibroblastenmarker, aber ohne HLA-DR-Expression oder andere monozytäre Antigene (zwischen 20% und 40% der Gesamtmenge), was 1987 mit geklonten Zellen und Zellkulturen bestätigt wurde.21 Die Bedeutung dieser Synovialzellen lag u.a. in der Aktivierung des Proto-Onkogens c-jun als Reaktion auf den Stimulus des IL-a,22 das ähnlich wie die neoplastischen Zellen die Kollagenase-Expression erhöht mit der Fähigkeit, zusammen mit Stromelysin und anderen Metalloproteinasen die Knorpel- und Knochenmatrix zu zerstören,23,24 eine Erkenntnis, die bereits 1960 von Ziff beschrieben wurde.11
Zvaifler und Firestein25 vertraten 1994 die Ansicht, dass der Ursprung des Pannus unklar sei und dass eine Unterteilung in ein chronisch entzündetes Synovialgewebe und ein spezialisiertes, hoch vaskularisiertes Bindegewebe, das an der Synovia-Knochen-Interphase beginnt und historisch als Ort des Beginns des destruktiven Prozesses definiert wurde, möglich sei.5,10,26,28 In dieser Übersichtsarbeit wurden zwei Möglichkeiten über den Ursprung dieser Synoviozyten in Betracht gezogen, die den Fibroblasten ähneln und den Namen Pannozyten erhielten.20 Die erste Hypothese war, dass die unreifen mesenchymalen Zellen als erste in die Gefäße eindringen, die den Knorpel durchdringen und ersetzt werden oder sich zu Fibroblasten entwickeln könnten,27 in einem Prozess, der durch unbekannte Entzündungsfaktoren (Faktor X) vermittelt wird, unabhängig von T-Zell-abgeleiteten Immunfaktoren, wie auch in Tiermodellen gezeigt wurde.29,30 Die zweite, weniger unterstützte Hypothese, die auf Studien aus den frühen 90er Jahren beruht,31-33 war von den Zytokinen der Lymphozyten abhängig und beschrieb die reduzierte Genexpression von Lymphozyten und lymphozytären Produkten in den Geweben und in der Synovialflüssigkeit (Abb. 11).

Alternative Wege, über die der unbekannte Faktor „X“ bei RA die Pannusbildung induzieren könnte. Er kann über den T-Zell-abhängigen Weg oder über den Synoviozyten-Weg beginnen.25
Die Übersichtsarbeit von Zvaifler und Firestein25 versucht, nicht nur die Entstehung, sondern auch die Aufrechterhaltung von Pannus zu verstehen, basierend auf 2 Möglichkeiten: Die eine geht – wie schon 1989 erwähnt – von einem Tumormodell aus, bei dem die Synovialzellen durch ein Signal transformiert werden, das die Proliferation auslöst und die Expression von Onkogenen und die Produktion von Enzymen, die die Matrix oder Adhäsionsproteine abbauen, induziert.34,35 Diese Signale können von löslichen Molekülen wie Zytokinen oder von nicht näher spezifizierten ätiologischen Agenzien stammen. Aus dieser Perspektive sind Gewebe wie Knorpel oder Knochen nicht an ihrer Entwicklung beteiligt, sondern werden vom Pannus betroffen. Die zweite Möglichkeit basiert auf der Idee, dass Verbindungen, die von Chondrozyten oder Immunkomplexen, die in den Knorpel eindringen, erzeugt werden, für die Aktivierung der Synoviozyten verantwortlich sind, damit sie in das Gewebe eindringen und ihre natürliche Umgebung verlassen.
Der Prozess, durch den die Fibroblasten-ähnlichen Synoviozyten, denen Fc-Rezeptoren fehlen, von diesen Immunkomplexen36 betroffen werden, ist jedoch nicht geklärt, aber es ist wahrscheinlich, dass die monozytär-makrophagen Zellen die Vermittler sind. Eine wahrscheinliche Erklärung für dieses Ereignis ist die Bindung von Komplementproteinen und Immunkomplexen an Vitronectin und seine Rezeptoren, die die Differenzierung, Migration und Proliferation von Fibroblasten beeinflusst und die anschließend durch den Kontakt dieser Zellen mit Kollagen, Fibronectin und anderen Metalloproteinasen verstärkt wird,37,38 über die Expression von Rezeptoren wie VCAM-1, das bis dahin das einzige bekannte Adhäsionsmolekül war, das in den fibroblastenähnlichen Synoviozyten überexprimiert wurde.39
Nach diesem zweiten Szenario ist der Knorpel nicht nur das vom Pannus betroffene Gewebe, sondern auch der Auslöser und Verewiger dieser Reaktion. Ungeachtet dessen ist es immer noch klar, dass die Erhaltung des Pannus von den Zytokinen abhängt, die das Zellwachstum und die Produktion von Enzymen stimulieren, die von den aus Monozyten stammenden Synoviozyten40 und den fibroblastenartigen Synoviozyten synthetisiert werden. Es wurde in vitro gezeigt, dass die Enzyme über die Regulierung und Vermittlung von T-Lymphozyten, Monozyten und deren Nebenprodukten synthetisiert werden41 , die den größten Teil der Zellen im Pannus ausmachen.42
Die Arbeit von Burmester 198320 war grundlegend für die Kontinuität der Untersuchung der zellulären Komponente des Pannus. Die Gruppe von Xue untersuchte 1997 Arthroplastikproben mit Pannus von Patienten mit RA und beobachtete PSC-Zellen, die phänotypisch mittels Mikroskopie und Immunhistochemie untersucht wurden und eine spezifische Protein- und Genomexpression aufwiesen.43 Diese Zellen waren positiv für Vimentinfilamente, Immunfluoreszenzmarker (Abb. 12) und ähnelten unter dem Mikroskop morphologisch den Fibroblasten. Allerdings waren auch der Safranin-O-Marker, der mit Proteoglykanen reagiert (Abb. 13), sowie die mRNA-Expression von Typ-II-Kollagen, das zur Identifizierung chondrozytenähnlicher Zellen verwendet wird, positiv; daher die Schlussfolgerung, dass diese Zellen eine Kombination aus Fibroblasten und Chondrozyten sind.
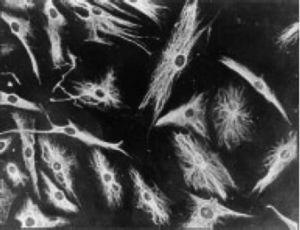
Immunfluoreszenzmikroskopische Aufnahme, die die Positivität der PSC-Zellen für Anti-Vimentin-Antikörper zeigt, die mit Fluoresceinisothiocyanat markiert sind. Dies ähnelt den Befunden in Fibroblasten.43
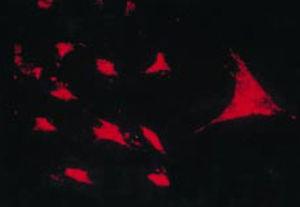
In situ Reverse-Transkriptase-Assay zur Darstellung der Expression von Typ-II-Kollagen-RNA in einer PSC-Kultur, die chondrozytenähnliche Eigenschaften vermittelt.43
Die Genomexpressionsstudie belegte auch die hohe Aktivität der Proto-Onkogene für c-myc, c-jun und c-fos, die die hohe Produktion von Enzymen wie Cathepsin B und L und einiger Kollagenase ermöglicht.
In späteren Jahren wurden weitere Hinweise auf die Charakteristika des Gewebes in der frühen Gelenkerkrankung und die erhöhte Expression des p53-Gens bekannt,44 Mutationen, die in fortgeschrittenen Stadien häufiger zu sehen waren.45 Im Jahr 2003 beobachteten Smeets et al. Unterschiede in den zellulären Eigenschaften, der Zytokinexpression, den angiogenen Faktoren und den Metalloproteinasen des Pannus, der aus Proben von Patienten mit einer späten Erkrankung gewonnen wurde, die sich einem Gelenkersatz unterzogen und keine Anzeichen einer klinischen Aktivität der Arthritis aufwiesen, im Vergleich zu Patienten, die sich einer Arthroskopie unterzogen und als im frühen Stadium der Erkrankung befindlich galten, weil sie noch eine klinische Aktivität der Arthritis aufwiesen.46 Die Unterschiede zwischen den beiden Gruppen waren die größere Anzahl von Makrophagen und T-Lymphozyten, die aus den Arthroskopie-Proben oder aus dem frühen Krankheitsstadium stammten, und die höhere Expression von TNF-a, IL-6, Metalloproteinasen (MMP-1, MMP-3, MMP-13) und des Angiogenese-Faktors (VEGF).
Pannus wird oft als fibröses Gewebe ohne größere biologische Aktivität und als ein Überbleibsel der Gelenkschädigung angesehen, das irreversibel zu sein scheint. Pannus verhält sich jedoch wie ein Medium, das große Mengen an proteolytischen Enzymen produziert, die eine zentrale pathologische Rolle spielen, wie z. B. die MMP 1, 3, 13 und 14.47 Insbesondere MMP 3 oder Stromelyn (oben erwähnt)23,24,48 wird intensiv produziert, wie 200549 durch mRNA-Nachweis an der Synovium-Knorpel-Grenze gezeigt wurde, und ist für die Synthesestimulation IL-1b-abhängig. MMP 3 unterscheidet sich von MMP 1 oder Kollagenase Typ 1, da sie weniger häufig vorkommt und durch TNF-a stimuliert wird.
Pannus und Kappa-B-Kernfaktor
Der Kappa-B-Kern-Transkriptionsfaktor (NF-kB) ist einer der wichtigsten Regulatoren der genomischen Transkription von Zytokinen, Chemokinen und Adhäsionsmolekülen; Er spielt eine Rolle beim Knorpel- und Gelenkknochenabbau,50 ist sowohl im Synovialgewebe von Patienten als auch in Tiermodellen mit RA erhöht,51-53 vor allem an der Pannus-Knorpel-Grenze53 , wo es eine größere Anzahl von Faktor-produzierenden Zellen gibt, als an anderen synovialen Stellen außerhalb dieser Grenze. Die Relevanz des NFkB-Faktors in Bezug auf Gelenkschäden zeigt sich nicht nur in der erhöhten Anzahl von Zytokinen, sondern auch in der Osteoklastogenese – einem Schlüsselprozess bei der Knochenerosion,54,55 die von der myeloischen Linie und dem RANK-RANKL-Komplex abhängt,56-58 der die Aktivierung, Migration und das Überleben der Osteoklasten ermöglicht.59,60 RANKL wird von T-Lymphozyten, fibroblastenähnlichen Synoviozyten und Zellen außerhalb der Pannus-Knochen-Grenzfläche gebildet.50,61-63 Pettit et al. untersuchten 200664 das RANKL-Expressionsmuster, NF-kB und Osteoprotegerin (ein natürlicher Inhibitor von RANKL, der dessen Bindung an den Rezeptor blockiert und somit die Osteogenese verhindert) in Pannusproben von Patienten mit RA, speziell an der Pannus-Knochen-Grenzfläche, wo es noch nie untersucht worden war. Das Ergebnis war, dass sowohl RANKL als auch Osteoprotegerin in Mikroumgebungen exprimiert werden, in denen der Pannus an den Knochen oder den Knorpel angrenzt und es zu Erosionen oder Gewebeschäden kommt, und zwar immer in Proportionen, die die Reifung des Osteoklasten und seine Aktivierung begünstigen. Dieses molekulare Ungleichgewicht wurde 2008 bestätigt.65
Diagnostische Bilder und Pannus
Im Jahr 1978 war Cooperberg der erste, der eine Synovitis mit Ultraschall zeigte, indem er eine Verdickung der Synovialmembran des Knies in einem Graustufenbild beobachtete.66 Weitere Details wurden in der Arbeit von De Flaviis 1988 beobachtet, der ein Ultraschallprotokoll an der Hand von Patienten mit RA durchführte.67 6 Jahre vergingen, bis Newman die Doppler-Methode an Sehnen und Schleimbeuteln anwandte,68 und 2 Jahre später nutzte er sie für Synovialverdickungen an den Knien von Patienten mit RA.69 Natias Hau setzte 1999 mit hochauflösendem Ultraschall den Dopplermodus erstmals am Pannus der Hände von Patienten mit RA ein und zeigte eine Hypervaskularisation70 der Kniegelenke und bestätigte damit die bereits in Studien ein Jahrhundert zuvor beschriebene erhöhte Vaskularisation (Abb. 14).5,12,14,15
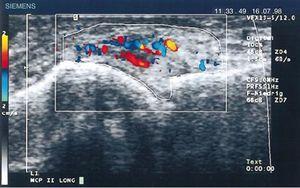
Longitudinal-Ultraschall des Metacarpophalangealgelenks zeigt die ersten Doppler-Bilder mit erhöhter Pannusvaskularisation bei einem Patienten mit RA.70
Nachdem die Veränderungen im Synovialgewebe mittels Ultraschall gezeigt wurden, war der nächste Schritt, festzustellen, ob dieser Pannus, wie er klinisch gesehen wird, auch eine Involution aufweist. Der erste, der diese Art von Ultraschalluntersuchung durchführte, war Newman im Jahr 1996, als er Doppler bei RA69 einsetzte und Veränderungen in der Menge der Vaskularisation nach intraartikulärer Steroidtherapie feststellte. Die gleichen Ergebnisse wurden in der Arbeit von Stone im Jahr 2001 gesehen.71 Er verglich die Bilder von Metacarpophalangealgelenken vor und nach einer intravenösen Methylprednisolon oder oralen Prednisolon-Therapie. Unter Verwendung von TNF-a-Inhibitoren veröffentlichten Hau et al. 2002 eine Arbeit, in der sie die Veränderungen der Vaskularisation des Pannus72 bei mit Etanercept behandelten Patienten und auch in nachfolgenden Studien zeigten.73-76 Taylor zeigte die Veränderung der Hypervaskularisation unter Infliximab77 und Naredo tat dasselbe 2008.78
Der Einsatz der Magnetresonanz, der 1988 mit der Arbeit von Gilkenson begann, zeigte, dass dies eine bessere Methode zur Erkennung von Erosionen der Hand bei Patienten mit RA79 ist; Kusunoglu zeigte 1990, dass sie nützlich ist, um eine synoviale Verdickung von einem Gelenkerguss zu unterscheiden.80 Die Visualisierung des Pannus mit dieser Methode begann 1994, als Ostergaard zum ersten Mal die Synovialverdickung und ihre Beziehung zur Aktivität der Erkrankung beurteilte,81 bestätigt durch eine umfangreichere Arbeit von Sugimoto 1998,82 und schließlich definierte die OMERACT-Gruppe 2003 die Synovitis in der Kernspinresonanz als eine Zunahme der Synovialdicke nach Kontrastmittelinjektion; dies ist definitiv der Nachweis eines Pannus.83
Schlussfolgerungen
Die Geschichte hat es ermöglicht, die kritische Rolle des Pannus bei der Gelenkzerstörung zu verstehen, der manchmal einer Tumorläsion ähnelt, weil er schnell und reichlich wächst und die Produktion von Antikörpern begünstigt, die den Autoimmunprozess perpetuieren. Dies widerspricht der Vorstellung, dass Pannus ein kaum aktives Granulationsgewebe ist, das sich darauf beschränkt, lediglich ein Rest von Narbengewebe zu sein. Diese Eigenschaften stören die Prozesse der Entwicklung, des Fortschreitens und der Zerstörung des Gelenkknochens und -knorpels, die seit über 100 Jahren nachgewiesen und mit mikroskopischen und molekularbiologischen Techniken belegt wurden. Daher ist die Vorstellung, dass Pannus ein endgültiger oder irreversibler Zustand ist, falsch, da er kein aktiver Teil der Krankheit ist, sondern im Gegenteil als Reaktion auf die Behandlung rückgängig gemacht werden kann. Die falsche Verwendung des Begriffs sollte vermieden werden, um die klinische Bewertung der Krankheit weniger verwirrend zu machen. Diese Veränderungen wurden historisch der Synovitis zugeschrieben, die einfach die Entzündung des Synovialgewebes ist, die klinisch bewertet wird. Der Begriff Synovitis kann nicht von Pannus unterschieden werden, da er sich auf einen histologischen Befund bezieht, und daher wird Pannus von den verschiedenen wissenschaftlichen Gesellschaften weder in der klinischen Erstbewertung noch in der Nachsorge von Patienten mit RA erfasst.
Weitere Studien zum Pannus als unverzichtbarem Bestandteil der Pathogenese der RA werden dazu beitragen, die Erkrankung von Anfang an besser zu verstehen und neue Wege für ihre klinische oder bildgebende Beurteilung zu eröffnen sowie gezieltere Therapien zu identifizieren, die die Zerstörung der Gelenke hemmen.
Interessenkonflikt
Die Autoren haben keine Interessenkonflikte offenzulegen.