Abstract
Hintergrund
Die Diagnose des akuten Myokardinfarkts (AMI) wird derzeit durch die Bestimmung von Plasma-Troponin I (pTi) bestätigt. Basierend auf den früheren Berichten, dass die Thrombozyten von AMI-Patienten, die durch verschiedene Aggregationsmittel aggregiert wurden, nicht durch Acetylsalicylsäure (Aspirin) gehemmt werden konnten, wurde die Möglichkeit der Diagnose eines AMI untersucht.
Methoden
Probanden zwischen 40-60 Jahren mit entweder AMI (n=50, M=35, F=15) oder ACS (n=30, M=20, F=10) und eine gleiche Anzahl von alters- und geschlechtsgematchten Normalprobanden nahmen an der Studie teil. Die Hemmung der durch 2,0 µM ADP induzierten Thrombozytenaggregation durch 80 µM Aspirin wurde untersucht, indem das thrombozytenreiche Plasma (PRP) für 30 min bei 37°C mit der Substanz inkubiert und die Aggregation in einem optischen Aggregometer durchgeführt wurde.
Ergebnisse
Während im Fall von normalem PRP die Aspirin-induzierte Hemmung ≈100% betrug. Im Fall von ACS betrug die prozentuale Hemmung 63,2 % im Vergleich zu den Fällen von AMI, wo keine Hemmung (d.h. 0 % Hemmung, p<0,001) durch Aspirin in der ADP-induzierten Thrombozytenaggregation gefunden wurde (Sensitivität = 92 % und Spezifität = 100 %).
Schlussfolgerung
Es war möglich, das Auftreten eines AMI durch das Fehlen der hemmenden Wirkung von Aspirin auf die Thrombozytenaggregation zu diagnostizieren.
Schlüsselwörter
Thrombozytenaggregation, Myokardinfarktdiagnose, Troponin, Aspirin.
Einleitung
Die Aggregation von Thrombozyten durch verschiedene thrombozytenaggregierende Agenzien wie ADP, L-Epinephrin, Kollagen oder Thrombin ist bekanntlich essentiell für den lebenswichtigen Prozess der Blutgerinnung . Andererseits wird berichtet, dass eine übermäßige Thrombozytenaggregation an der Stelle einer atherosklerotischen Plaqueruptur an der Wand der Koronararterie zur Entwicklung eines Thrombus führt, einem Mikroaggregat von Thrombozyten, das manchmal zu einer Blockade der normalen Blutzirkulation in der Herzmuskulatur führen kann, was in der Folge zu einem akuten Koronarsyndrom (ACS) führen kann. Obwohl die Aggregation von Thrombozyten an der arteriellen Plaque-Rupturstelle zu einem ACS führen kann, kann die Aggregation von Thrombozyten manchmal auch die Herzbeutelarterie blockieren, was zum Absterben von Herzzellen führen kann, die als dunkle, fleckige Bereiche von Infarkten erscheinen, die durch das Absterben von Herzzellen entstanden sind, was letztendlich zu einem akuten Myokardinfarkt (AMI) führen kann, der, wenn er massiv ist, zum Tod der Opfer führen kann. Die transmuralen Infarkte hängen vom Ausmaß der Schädigung des Myokards ab, die sich nicht immer als abnormale Q-Welle äußern kann, sondern in 50 % der Fälle auch mit dem Auftreten von abnormalen ST- und T-Wellen im EKG einhergeht, was zu einem STEMI (St-Elevated Myocardial Infarction) oder einem Nicht-STEMI führt, und als solches kann das EKG nicht diagnostisch nützlich sein, um das Auftreten eines AMI zu bestimmen. Obwohl der Brustschmerz in der Regel stark ist und länger anhält als bei einem ACS, ist der Schmerz selbst bekanntermaßen subjektiver Natur und kann ein simuliertes Ereignis sein, das nicht durch den AMI selbst verursacht wurde. Daher wird die Diagnose eines AMI in der Regel durch die Bestimmung des Plasma-Troponins I (pTi) mittels Enzyme Linked Immuno sorbent Assay (ELISA) unter Verwendung von Troponin-I-Antikörpern bestätigt.
Allerdings sind sowohl Troponin I (Ti) als auch sein Antikörper teuer, und darüber hinaus ist der ELISA selbst nicht immer ausreichend schnell, um das Auftreten eines AMI in einer anspruchsvollen Situation zu bestätigen, was für eine mögliche therapeutische Intervention für die Erkrankung erforderlich sein kann. Aus diesen Gründen ist die Labordiagnose von AMI in vielen Teilen der Welt nicht verfügbar, nicht unbedingt freiwillig.
Wir haben kürzlich berichtet, dass das Platelet Rich Plasma (PRP) von AMI-Patienten, das mit 80 µM Acetylsalicylsäure (Aspirin) für 30 min bei 37°C vorinkubiert wurde, die Aggregation von Thrombozyten, die durch verschiedene Thrombozytenaggregationsmittel, einschließlich ADP, initiiert wurde, nicht hemmen konnte, verglichen mit dem normalen PRP oder dem PRP von ACS. Basierend auf diesen Vorstudien haben wir die Möglichkeit untersucht, das Auftreten von AMI durch optische Aggregometrie auch ohne die Bestimmung des pTi zu bestätigen.
Wir berichten hier über die Möglichkeit, das Auftreten von AMI differenziert vom Auftreten von ACS durch die Bestimmung der Aspirin-induzierten Hemmung der durch ADP induzierten Thrombozytenaggregation mit einem Aggregometer zu bestätigen. Das Auftreten von AMI wurde durch parallele und gleichzeitige Bestimmung des pTi mittels ELISA bestätigt.
Methoden und Materialien
Ethische Freigabe
Für das Forschungsprojekt “Labordiagnose des akuten Myokardinfarkts durch optische Aggregometrie der Thrombozyten“ wurde eine nominelle Blutmenge (2 mL) von Patienten mit AMI oder ACS und von normalen Probanden benötigt. Das Institutional Review Board, Human & Animal Research Ethics Committee, Sinha Institute Of Medical Science And Technology, Kolkata, Indien genehmigte die Studie unter der Bedingung, dass das genehmigte Human-Ethik-Protokoll strikt in Übereinstimmung mit der Helsinki-Deklaration von 1964 befolgt wurde und keine Abweichung in der Studie ohne vorherige schriftliche Genehmigung des Gremiums erlaubt war. Alle Teilnehmer waren zwischen 40-60 Jahre alt. Es nahmen keine geistig behinderten, schwangeren Frauen oder Gefangene an der Studie teil. Alle Probanden unterzeichneten vor ihrer Teilnahme an der Studie eine Einverständniserklärung. Bei Probanden mit ACS oder AMI wurde die Erlaubnis zur Teilnahme an der Studie auch von den Angehörigen des Patienten durch Unterzeichnung einer eidesstattlichen Erklärung eingeholt. Die behandelnden Ärzte entschieden, ob die Blutprobe (2 ml) dem Patienten entnommen werden konnte, ohne den Probanden in Gefahr zu bringen. Die Blutentnahme erfolgte durch den behandelnden Arzt oder durch eine examinierte Krankenschwester. Es wurde sichergestellt, dass die Probanden keine andere lebensbedrohliche Infektion hatten. Das Komitee überprüfte routinemäßig den Verlauf und die Probleme der laufenden Untersuchung.
Chemikalien
Die Ziegen-Anti-Kaninchen-Immunglobulin G-alkalische Phosphatase und ADP wurden von Sigma Aldrich bezogen. Enzyme Linked Immunosorbent Assay (ELISA) maxisorp Platten waren von Nunc, Rosaklide, Dänemark. Troponin I, Troponin I-Antikörper, CK-MB, CK-MB-Antikörper wurden von Abcam bezogen. Acetyl Salicylic Acid (Aspirin) wurde von Medica Zydus Healthcare bezogen. Alle anderen verwendeten Chemikalien waren von analytischer Qualität.
Auswahl der AMI-Patienten
Eine Gesamtzahl von 50 Patienten (n=50, M=35, F=15, im Alter von 40-60 Jahren mit Brustschmerzen, die >120h andauerten, nahm an der Studie teil. Diese Probanden wurden auf der Intensivstation des Calcutta Medical College and Hospital aufgenommen. Die Patienten mit Diabetes mellitus oder einer lebensbedrohlichen Infektion wurden nicht in die Studie aufgenommen. Da Parikarditis, Lungenembolie, Aorten- und Darmerkrankungen bekanntermaßen Brustschmerzen aufgrund eines AMI oder ACS auslösen können, wurden Patienten mit diesen Erkrankungen sorgfältig von der Studie ausgeschlossen. Alle Teilnehmer, die innerhalb der letzten sechs Monate mit irgendeiner Erkrankung ins Krankenhaus eingeliefert wurden oder Patienten, die innerhalb von 2 Wochen Aspirin erhalten hatten, wurden von der Studie ausgeschlossen.
Auswahl der normalen Probanden
Eine gleiche Anzahl von alters- und geschlechtsgleichen normalen Probanden wurde ebenfalls in die Studie aufgenommen. Keiner der normalen Probanden hatte Diabetes mellitus oder eine Vorgeschichte von systemischer Hypertonie bei der Präsentation. Keiner der normalen Probanden hatte eine lebensbedrohliche Infektion oder war innerhalb der letzten sechs Monate wegen einer Erkrankung ins Krankenhaus eingeliefert worden. Keine der weiblichen Probanden hatte jemals irgendwelche empfängnisverhütenden Medikamente erhalten. Keiner der Probanden hatte innerhalb der letzten 4 Wochen Aspirin oder andere Herzmedikamente eingenommen.
Diagnose des AMI
Alle AMI-Patienten wurden auf der kardiologischen Intensivstation des Krankenhauses mit den oben beschriebenen charakteristischen Brustschmerzen aufgenommen. AMI-Patienten mit sowohl STEMI als auch Nicht-STEMI wurden in die Studie aufgenommen. Alle ausgewählten Patienten hatten sich entwickelnde Q-Wellen im EKG. Diejenigen Fälle, bei denen das Auftreten von Q-Wellen im EKG nicht eindeutig nachgewiesen werden konnte, wurden von der Studie ausgeschlossen. Das Auftreten von AMI wurde durch die pTi-Werte mittels ELISA bestätigt.
Diagnose von ACS
Als Teil der beabsichtigten Studie wurden 30 Patienten (n=30, M=20, F=20) im Alter von 40-60 Jahren in die Studie aufgenommen. Diese Patienten hatten charakteristische Brustschmerzen. Diejenigen Patienten, die einen Schenkelblock hatten und bei denen die Regionen der kardialen Ischämie nicht durch das EKG festgestellt werden konnten, wurden von der Studie ausgeschlossen.
Das Auftreten eines ACS wurde durch die Bestimmung von CK-MB in der Blutprobe bestätigt, indem die Probe innerhalb von 6h nach Aufnahme im Krankenhaus entnommen wurde.
Die Blutproben wurden sowohl bei AMI als auch bei ACS von den Probanden vor Beginn einer kardialen Therapie entnommen, um Unklarheiten zu minimieren.
Studienprotokoll
Die ausgewählten Patienten wurden randomisiert und jeder Blutprobe von AMI, ACS und von normalen Probanden wurde eine willkürliche Nummer zugewiesen und unter der Aufsicht eines Sachbearbeiters, der kein Untersucher war, aufbewahrt. Der Untersucher hatte keine Kenntnis darüber, ob die entnommenen Blutproben von einem AMI oder ACS oder von einem normalen Probanden stammten. Erst nach Abschluss der Studie stand der „Schlüssel“ zu den Informationen über den Zustand des Teilnehmers den Prüfärzten für statistische Analysen zur Verfügung. Alle Blutproben wurden so schnell wie möglich nach der Probenentnahme untersucht.
Zubereitung von plättchenreichem Plasma (PRP)
Das PRP der Probanden wurde durch Zentrifugation wie zuvor beschrieben aufbereitet.
Das plättchenfreie Plasma (PFP), das für die Bestimmung von CK-MB oder pTi verwendet wurde, wurde durch Zentrifugation der Blutproben bei 10.000 g bei 0°C hergestellt.
Hemmung der Thrombozytenaggregation durch Aspirin
Typischerweise wurde das PRP von Probanden mit AMI, ACS oder von normalen Probanden mit 80 µM Aspirin für 30 min bei 37°C inkubiert. Die Aggregation der Thrombozyten wurde durch Behandlung des PRP mit 2 µM ADP vor der Inkubation mit oder ohne Aspirin initiiert. In den Kontrollexperimenten wurde das PRP mit einem gleichen Volumen von 0,9% NaCl behandelt und für 30 min bei 37°C inkubiert.
Zubereitung der Aspirinlösung
Frisch hergestellte Aspirinlösung wurde durch Auflösen von Aspirin in entionisiertem Wasser hergestellt und der pH-Wert wurde durch Zugabe von 0,1M NaHCO3 auf 7,0 gehalten. Die Aspirin-Lösung wurde nach Gebrauch verworfen.
Bestimmung von Plasma-Troponin I und CK-MB
Die pTi- und CK-MB-Werte wurden mittels ELISA unter Verwendung von Troponin I-Antikörpern und CK-MB-Antikörpern bestimmt.
Statistische Analyse
Die erhaltenen Ergebnisse werden als +/- Standardabweichung dargestellt, während die Signifikanz der Ergebnisse mit Hilfe des Student’s t-Tests bestimmt wurde. Werte von p<0,05 wurden als signifikant angesehen. Gegebenenfalls wurden auch die Pearsonschen Korrelationskoeffizienten ® der Ergebnisse ermittelt. Der Pearson-Wert „r“, ist so, dass -1 ≤ r ≤ +1 akzeptabel ist, wobei die Zeichen (+) und (-) als positive lineare Korrelationen bzw. negative lineare Korrelationen bezeichnet werden. Für die statistischen Analysen wurden die Software Graph Pad Prism (Graph Pad Software, San Diego, und USA) und die Software Micro Cal origin 6.0 verwendet. Die diagnostische Testauswertung und Receiver Operator Curve (ROC)-Analyse wurde mit der statistischen Software, MedCalc, Belgien, durchgeführt. Gemäß der ROC-Analyse hat ein Test mit perfekter Diskriminierung (keine Überlappung in zwei Verteilungen) eine ROC-Kurve, die durch die obere linke Ecke verläuft (100% Sensitivität, 100% Spezifität). Je näher die ROC-Kurve also an der oberen linken Ecke liegt, desto höher ist die Gesamtgenauigkeit des Tests. Die Fläche unter der Kurve (AUC) wurde quantifiziert, die ein Maß dafür ist, wie gut ein Parameter zwischen zwei Diagnosegruppen (krank/normal) unterscheiden kann.
Ergebnisse
Die Wirkung von Aspirin auf die Hemmung der durch ADP induzierten Thrombozytenaggregation in PRP von Probanden mit ACS, AMI und von normalen Probanden
Wenn das PRP von diesen Probanden mit 80 µM Aspirin für 30 min bei 37°C inkubiert und die Thrombozytenaggregation durch Behandlung des PRP mit 2.0µM ADP wurde die Thrombozytenaggregation ausgelöst. Nur im Falle des PRP von AMI-Probanden konnte die Substanz die Thrombozytenaggregation nicht hemmen (0% Hemmung). Im Gegensatz dazu wurden die Thrombozyten bei ACS (prozentuale Hemmung von 52%-68%) oder bei normalem PRP zu 100% gehemmt (Abbildung 1, Panel A). Die Receiver-Operator-Curve (ROC)-Analyse zeigte eine Sensitivität von 92% (95% Konfidenzintervall (CI): 91,0-100,0) und eine Spezifität von 100% (95% CI: 91,0-100,0, P<0,0001). Die mittels ROC-Analyse getestete Fläche unter der Kurve (AUC) ergab einen Wert von 0,952 (Abbildung 1, Panel B).
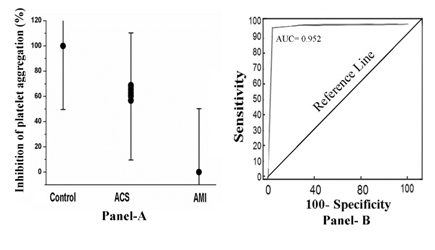
Abbildung 1. Die prozentuale Hemmung der Thrombozytenaggregation und die Receiver-Operator-Curve-Analyse im PRP durch Aspirin bei normalen, ACS- und AMI-Patienten. Panel A: Das PRP von normalen, ACS- und AMI-Probanden wurde wie in Materialien und Methoden beschrieben vorbereitet und mit 80 µM Aspirin für 30 min bei 37°C inkubiert. Nach der Inkubation wurde die Thrombozytenaggregation durch Zugabe von 2 µM ADP initiiert und in einem optischen Aggregometer untersucht. Tafel B: ROC-Kurvenanalyse der Hemmung der Thrombozytenaggregation, in der die Sensitivität gegen die Spezifität für verschiedene Cut-off-Punkte aufgetragen ist. Jeder Punkt auf der ROC-Kurve stellt ein Sensitivitäts/Spezifitäts-Paar dar, das einer bestimmten Entscheidungsschwelle entspricht, wie in Methoden und Materialien beschrieben.
Zusammenhang zwischen dem pTi und der Aspirin-induzierten Hemmung der Thrombozytenaggregation durch ADP bei AMI, ACS und in normalem PRP.
Wie in (Abbildung 2, Tafel A) gezeigt, wurde festgestellt, dass der Anstieg des pTi in umgekehrtem Verhältnis zum Ausmaß der Aspirin-induzierten Hemmung der Thrombozytenaggregation steht. Mit anderen Worten, der Anstieg von pTi, der im Falle einer AMI maximal war, führte auch zur Entwicklung einer maximalen Resistenz der Thrombozyten gegenüber der hemmenden Wirkung von Aspirin (Korrelationskoeffizient, Pearson’s r= -0,967, mit p<0.001), und die Aspirin-induzierte Hemmung der Thrombozytenaggregation war maximal mit dem völligen Fehlen von pTi in normalem und dem pTi-Niveau in ACS-Plasma verbunden, das mehr als das in normalem Plasma war, was zeigt, dass Troponin I auch in ACS-Plasma vorhanden war, wenn auch weniger als das in AMI. Die Receiver-Operator-Kurve (ROC-Analyse) zeigte eine Sensitivität von 85% (95% Konfidenzintervall (CI): 81,0-92,0) und eine Spezifität von 78% (95% CI: 75,0-80,0, P<0,0001). Die mittels ROC-Analyse getestete Fläche unter der Kurve (AUC) ergab einen Wert von 0,739 (Abbildung 2, Panel B).
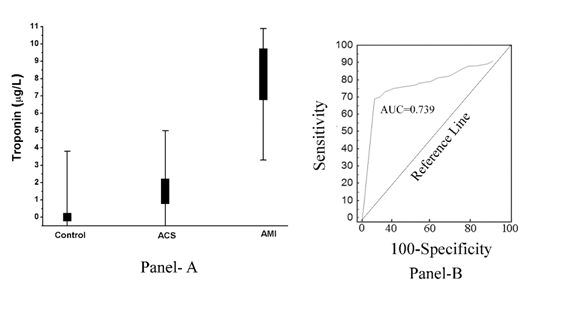
Abbildung 2. Plasma Troponin I Level in normalen, ACS und AMI Probanden und seine ROC Analyse. Tafel A: Der pTi-Spiegel wurde mittels ELISA unter Verwendung des Troponin I-Antikörpers bestimmt, wie in Materialien und Methoden beschrieben. Jeder Punkt ist eigentlich eine Überlappung von 50 normalen, 30 ACS- und 50 AMI-Patienten. Panel B: ROC-Kurvenanalyse der pTi-Werte bei normalen (nicht erkrankten) und AMI-Patienten (erkrankten) wurde mit MedCalc erstellt, wie in Methoden und Materialien beschrieben.
Diskussion
Der akute Myokardinfarkt, von dem berichtet wird, dass er durch eine Thrombose verursacht wird, die zum Absterben der Herzzellen führt, ist wohl die gefährlichste thrombotische Erkrankung, die zu einer großen Anzahl von Todesfällen unter den Opfern führt. Im Gegensatz zum ACS, bei dem das Wiederauftreten der Erkrankung durch Aspirin durch die Hemmung der übermäßigen Aggregation der Thrombozyten verhindert werden soll, sind die Thrombozyten beim AMI aufgrund des Auftretens der Dermcidin-Isoform-2 (DCN-2) im Blutkreislauf resistent gegen die hemmende Wirkung der Substanz. Aufgrund der fehlenden Aspirin-induzierten Hemmung der Thrombozytenaggregation kam es leider bei den meisten Erstopfern innerhalb weniger Monate zu einem Wiederauftreten des AMI und sie erlagen der Erkrankung. Es wurde berichtet, dass DCN-2 ein potenter Inhibitor der Aspirin-induzierten Stickstoffmonoxid (NO)-Synthese ist. Kürzlich wurde berichtet, dass durch die Entfernung des gebundenen DCN-2 von der Thrombozytenoberfläche durch eine erhöhte NO-Synthese in den Thrombozyten eine Resensibilisierung der AMI-Thrombozyten gegenüber der Aspirin-Wirkung möglich ist.
Nicht nur die Behandlung und Vorbeugung von AMI durch geeignete therapeutische Intervention bleibt problematisch, auch die Labordiagnose der Erkrankung, differenziert vom Auftreten eines ACS, bleibt für viele Labore in der Welt unerschwinglich, die in der Regel für die Bestätigung von AMI durch den pTi-Wert erforderlich ist. Dies ist auf die Tatsache zurückzuführen, dass sowohl Troponin I als auch sein Antikörper nicht nur teuer sind, sondern der Assay selbst mittels ELISA eine spezielle Ausrüstung und die notwendigen Chemikalien und Materialien benötigt, was ein zeitaufwändiges Verfahren sein könnte und in einer Situation, in der ein schnelles und bestätigendes Auftreten von AMI für die therapeutische Intervention wesentlich ist, notwendig ist. Darüber hinaus folgt die Interaktion zwischen einem Antigen und seinem Antikörper nicht der bekannten chemischen Stöchiometrie, so dass der Assay selbst Probleme bei der Validität der Interpretation der Daten aufweisen kann. Außerdem ist die Diagnose eines ACS, differenziert vom Auftreten eines AMI, durch die Bestimmung von Plasma-CK-MB an sich ein teures Verfahren.
Die oben dargestellten Ergebnisse legten die Durchführbarkeit der Diagnose eines AMI, differenziert vom Auftreten eines ACS, durch einfache Thrombozytenaggregometrie unter Verwendung eines gewöhnlichen Laboraggregometers innerhalb einer Stunde stark nahe (Sensitivität= 92% und Spezifität= 100%, wie durch ROC-Analyse bestimmt). Die Kurve des diagnostischen Tests, wie in Materialien und Methoden beschrieben, verläuft nahe an der oberen linken Ecke (Abbildung 1, Feld B), was eine nahezu 100%ige Genauigkeit des diagnostischen Tests im Vergleich zu pTi impliziert (Abbildung 2, Feld B).
Auch da die Aggregation von Thrombozyten in PRP bei AMI nicht durch Aspirin gehemmt werden kann, die Thrombozyten aus dem PRP von ACS-Patienten jedoch schon, könnte die Diagnose von AMI durch Thrombozytenaggregometrie ein wirtschaftliches sowie „Alles-oder-Nichts“-Ereignis sein, d. h. die Aggregation von Thrombozyten in PRP kann nicht gehemmt werden.d. h. die Aggregation der AMI-Thrombozyten konnte durch die Behandlung des PRP mit Aspirin nicht oder nur sehr eingeschränkt erreicht werden, im Gegensatz dazu konnte die Aggregation der Thrombozyten aus den ACS-Patienten durch den gleichen Wirkstoff deutlich gehemmt werden (Abbildung 1). Es zeigte sich jedoch, dass auch die Thrombozyten von ACS-Patienten etwas resistenter gegenüber der hemmenden Wirkung von Aspirin waren als die von normalen Thrombozyten. Auf der anderen Seite waren die Thrombozyten von AMI maximal resistent gegen die Wirkung von Aspirin, was umgekehrt mit den pTi-Werten zusammenhing (Korrelationskoeffizient (r) zwischen dem pTi-Wert und dem Prozentsatz der Hemmung durch Aspirin war -0.967, p<0,001).
Im obigen Zusammenhang sollte erwähnt werden, dass eine schnelle und bestätigende Diagnose des AMI für den Einsatz einer thrombolytischen Therapie notwendig ist, die die Sterblichkeitsrate beim AMI um 30-50% senken kann. Es sollte auch beachtet werden, dass etwa 50 % der Patienten mit erhöhtem pTi weder ST-Hebungen noch Q-Wellen im EKG haben, so dass die thrombozytenaggregometrische Diagnose des AMI eine noch diagnostisch nützlichere Methode als das EKG sein könnte, und gleichzeitig ist sie viel kostengünstiger als der ELISA zur pTi-Bestimmung.
Die Quantifizierung von pTi im Kreislauf von AMI-Patienten wird üblicherweise als Bestätigungsmarkerprotein für AMI durchgeführt. In einer Vorstudie wurde jedoch festgestellt, dass pTi auch ein Inhibitor der NO-Synthese und ein potenter Induktor der Thrombozytenaggregation ist, und zwar in ähnlichen Bereichen (nM) wie die pTi-Spiegel im AMI-Plasma (unveröffentlicht). Da jedoch der Plasmaspiegel von Troponin I bei ACS höher war als der in normalem Plasma, aber viel geringer als der bei AMI, ließen diese Ergebnisse vermuten, dass die Erhöhung von pTi auch bei ACS auftrat, aber fast 6-mal geringer als bei AMI. Diese Ergebnisse legten dennoch nahe, dass der erhöhte pTi im Vergleich zu normalem Plasma allein nicht unbedingt das Auftreten einer AMI in Abgrenzung zum möglichen Auftreten einer ACS bestätigt.
Wir haben kürzlich berichtet, dass der charakteristische Angina pectoris-Schmerz bei AMI mit der starken Reduktion des NO-Spiegels im Plasma zusammenhängt, die auf die Hemmung der NO-Synthese durch DCN-2 oder andere systemische Inhibitoren der Stickstoffmonoxid-Synthase zurückzuführen ist. Da pTi durch die Hemmung von NOS in Thrombozyten als neuartiges Thrombozytenaggregationsmittel gefunden wurde (unveröffentlicht), ist es möglich, dass pTi selbst zumindest teilweise an den Angina pectoris-Schmerzen beim AMI beteiligt sein könnte. Die Freisetzung von pTi in den Kreislauf aus der Herzmuskulatur könnte selbst thrombogen sein und zur Entwicklung einer Resistenz gegen die hemmende Wirkung von Aspirin in den Thrombozyten bei AMI beitragen, ähnlich wie die Wirkung von DCN- 2, was zur Auslösung oder Verschlimmerung der Erkrankung führt. Und so könnte das Vorhandensein von pTi selbst eine unheilvolle Rolle bei der Entwicklung einer Resistenz gegen die hemmende Wirkung von Aspirin in den Thrombozyten bei AMI haben, was zum Wiederauftreten der Erkrankung führt.
- Colman RW, Walsh PN (1987) Haemostasis andthrombosis. In: Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphia, PA (USA), J.B. Lippincott: 594-605.
- Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Plaque rupture, thrombosis, and therapeutic implications. Haemostasis 4: 269-284.
- Page DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) Myocardial changes associated with cardiogenic shock. N Engl J Med 285: 133-137.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inhibition of human blood platelet aggregation and the stimulation of nitric oxide synthesis by aspirin. Platelets 14: 421-427.
- Zweig MH1, Campbell G (1993) Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 39: 561-577.
- Bank S, Jana P, Maiti S, Guha S, Sinha AK (2014) Dermcidin isoform-2 induced nullification of the effect of acetyl salicylic acid in platelet aggregation in acute myocardial infarction. Sci Rep 4: 5804.
- Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) The appearance of dermcidin isoform 2, a novel platelet aggregating agent in the circulation in acute myocardial infarction that inhibits insulin synthesis and the restoration by acetyl salicylic acid of its effects. J Thromb Thrombolysis 31: 13-21.
- Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. TEAM-2 Study Investigators. Circulation 90: 94-100.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Reduction of death rate due to acute myocardial infarction in subjects with cancers through systemic restoration of impaired nitric oxide. PLoS One 9: e88639.