Ösophagus-Motilitätsstörungen sind oft eine vernachlässigte Erkrankung. Nicht nur, dass sich die unspezifischen klinischen Präsentationen wie Sodbrennen, Brustschmerzen und chronischer Husten häufig mit anderen häufigen Erkrankungen überschneiden, es mangelt auch an Geräten zur Prüfung der Ösophagusfunktion.
Die motorische Funktion der Speiseröhre wurde früher mit der konventionellen Manometrie bewertet, bei der die Ergebnisse in Form einer Linienverfolgung dargestellt wurden. Im Jahr 2001 schlugen Spechler und Castell1 vor, diese Daten für die Kategorisierung von Ösophagusmanometrie-Störungen in 4 Gruppen zu verwenden:
1. Unzureichende Entspannung des unteren Ösophagussphinkters (LES), bei der es sich um eine klassische Achalasie oder atypische Störungen der LES-Relaxation handeln kann.
2. Unkoordinierte Ösophaguskörperkontraktion, die sich auf einen diffusen Ösophagusspasmus bezieht.
3. Ösophagushyperkontraktion, die am Körper (Nussknacker-Ösophagus) oder am LES (hypertensives LES) auftreten kann.
4. Ösophaguskörper-Hypokontraktion, was eine ineffektive Ösophagusmotilität (IEM) bedeutet.
Im Jahr 1991 begannen Clouse et al.2 mit der Erstellung von topographischen Ösophagusplots aus einer konventionellen manometrischen Untersuchung und zeigten eine höhere diagnostische Genauigkeit für Ösophagusdysmotilität.3 Während der DDW-Tagung 2007 in San Diego arbeitete die Arbeitsgruppe für hochauflösende Manometrie (HRM) erstmals zusammen, um die Ösophagusdrucktopographie (EPT) zur Beurteilung der klinischen Ösophagusdysmotilität anzupassen. Im Jahr 2008 veröffentlichten Kahrilas et al.4 die erste Chicago-Klassifikation (CC) unter Verwendung der Ösophagusdrucktopographie zur Diagnose von Ösophagusmotilitätsstörungen, und später in den Jahren 2012 und 2015 wurden die CC-Versionen 2.0 bzw. 3.0 bekannt gegeben.5,6
Nach der CC-Version 3.0 wird die Ösophagusdysmotilität hauptsächlich klassifiziert in:
1. Schlecht entspannendes LES, das eine Achalasie oder eine Obstruktion der ösophagogastrischen
Junction (EGJ) sein kann.
2. Größere Störungen der Peristaltik: fehlende Kontraktilität, distaler Ösophagus
Krampf oder Presslufthammer-Ösophagus und
3. kleinere Störungen der Peristaltik: IEM oder fragmentierte Peristaltik.6
Hypotensive (end-exspiratorischer Ruhe-LES-Druck < 10 mmHg bei normaler Peristaltik) und hypertensive LES (end-exspiratorische Ruhe-LES > 35 mmHg bei normaler Peristaltik und EGJ-Relaxation), die beide in der CC-Version 1.04 erwähnt werden, werden in der Version 2.0 und 3.0.5, 6 Die in der CC-Version 3.0 genannten Ösophagusmotilitätsstörungen werden in diesem Artikel besprochen.
Achalasie
Diopathische Achalasie ist eine primäre Ösophaguserkrankung, die durch einen Verlust der Ösophagusperistaltik und eine Beeinträchtigung der LES-Relaxation gekennzeichnet ist.7 Bei etwa 3-4 % der Patienten mit Verdacht auf Achalasie handelt es sich um eine Pseudoachalasie,8 ein Zustand, der auftritt, wenn maligne Zellen den Plexus myentericus des distalen Ösophagus oder EGJ infiltrieren und zerstören. Die idiopathische Achalasie ist eine seltene Erkrankung. Die Inzidenz liegt bei 0,3-1,63 pro 100.000 Erwachsene pro Jahr,9-13 und die Prävalenz bei 8,7-11,2 pro 100.000 Erwachsene in 10 Jahren.9,13,14
Pathogenese der Achalasie ist die gestörte Funktion oder der Verlust der postganglionären inhibitorischen Neuronen im Plexus myentericus, die die glatte Muskulatur des distalen Ösophagus und des EGJ versorgen, indem sie zwei Neurotransmitter sezernieren: vasoaktives intestinales Polypeptid (VIP) und Stickstoffmonoxid (NO).15, 16 All dies zusammen führt zu einer ösophagealen Aperistaltik und einem schlecht entspannenden LES.17 Eine zytotoxische Lymphozyten- und/oder Komplementaktivierung kann diese chronischen Ganglionitits verursachen, insbesondere bei Patienten mit HLA DQA1*0103- und HLA DQB1*0603-Allelen.18 Einige Viren, z. B. Herpes simplex Virus-1 (HSV-1), Masern, Humanes Papillomavirus (HPV) und Varizella-Zoster-Virus (VZV), wurden als Hypothese für die Pathogenese der idiopathischen Achalasie herangezogen. Allerdings hat keine Studie diesen Zusammenhang eindeutig belegt.17, 19 Die klinischen Manifestationen der idiopathischen Achalasie korrelieren vermutlich mit dem Grad der Ösophaguspathologie. Anfänglich zeigen Patienten mit Ösophagusneuritis oder -ganglionitis überwiegend eine ausgeprägte Achalasie (Typ III Achalasie). Im weiteren Verlauf, wenn der inflammatorische Prozess zu einem Verlust von Ganglienzellen und einer Neuralfibrose führt, entwickeln die Patienten schließlich eine klassische Achalasie (Typ I) oder eine Achalasie mit Kompression (Typ II).17
Mehr als 90 % der Patienten mit Achalasie zeigen eine Dysphagie von festen und flüssigen Nahrungsmitteln. Weitere Symptome sind Sodbrennen, Regurgitation von unverdauter Nahrung, nicht-kardiale Brustschmerzen und Gewichtsverlust. Zusätzlich können bei Patienten mit Achalasie auch respiratorische Symptome wie Heiserkeit, Halsschmerzen, Husten und Lungenaspiration auftreten.19, 20 Die Ösophagogastroduodenoskopie (EGD) sollte bei Patienten mit Dysphagie zum Ausschluss einer mechanischen Obstruktion durchgeführt werden; die Sensitivität für die Diagnose einer Achalasie ist jedoch gering, insbesondere im Frühstadium.19 Die EGD-Befunde, die bei Achalasie gefunden werden können, sind ein dilatierter oder gewundener Ösophagus, zurückgehaltene Nahrung im Ösophaguslumen, ösophageale Candidiasis und ein gewisser Widerstand beim Durchführen des Gastroskops durch das EGJ.20
Die Barium-Ösophagographie hat ebenfalls eine geringe Sensitivität zur Bestimmung des frühen Stadiums der Achalasie. Ösophagusdilatation und Vogelschnabel-Erscheinung können bei idiopathischer Achalasie gefunden werden. Wenn die Länge der distalen Ösophagusverengung größer als 3,5 cm ist und die proximale Ösophagusdilatation weniger als 4 cm beträgt, sollte der Arzt vorsichtig sein und eine Pseudoachalasie vermuten.21
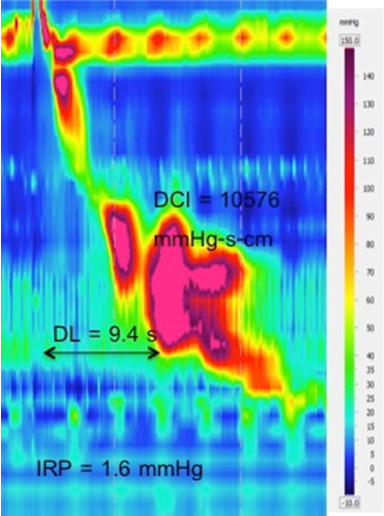
Nach der aktuellen CC-Version 3.0 wird die Achalasie in 3 Typen eingeteilt. Das Kriterium für die Diagnose einer Typ-I-Achalasie ist eine gestörte EGJ-Relaxation mit 100 % fehlgeschlagener Peristaltik (Abbildung 7). Fragmentierte Peristaltik ist ein Zustand mit mindestens 50% fragmentierter Kontraktion (ein Schluck mit DCI > 450 mmHg-s-cm und Bruch > 5 cm Länge in der 20-mmHg-Isobarenkontur) (Abbildung 7).6 Alle diese Ösophagus-Hypomotilitätsstörungen müssen ein normal entspanntes LES haben.
Zurzeit ist das Management der Ösophagus-Hypokontraktion zur Wiederherstellung der Ösophagusperistaltik noch begrenzt. Die derzeitige Behandlung zielt darauf ab, die begleitende GERD zu behandeln, die bei dieser Motilitätserkrankung häufig vorkommt.69 Eine Modifikation des Lebensstils kann den ösophagealen Bolustransit erhöhen und die ösophageale Säureexposition reduzieren.69 Das gründliche Kauen von Nahrung, der Verzehr von flüssigen und halbfesten Nahrungsmitteln, das Trinken von viel Wasser und die Verwendung von kohlensäurehaltigen Getränken können den ösophagealen Bolustransit befürworten und die Bolusretention verhindern.69 Eine Gewichtsreduktion, die Vermeidung der sofortigen Liegeposition nach dem Essen, die Hochlagerung des Kopfes im Bett, die linke seitliche Dekubitus-Lage und die Vermeidung von fettigen Nahrungsmitteln oder kalorienreicher Ernährung können helfen, die ösophageale Säureexposition und/oder die Häufigkeit von reflux-Symptomen zu reduzieren.78, 79 Darüber hinaus gibt es mehrere Studien, die zeigen, dass Kaugummikauen die ösophageale Säureexposition verringern und die Reflux-Symptome bei Patienten mit GERD lindern kann.80-82
Die pharmakologische Behandlung bei Patienten mit Ösophagus-Hypokontraktion besteht aus einer Säuresuppressionstherapie, einem alginatbildenden intra-gastrischen Floß, das sowohl saure als auch nicht-saure Refluxe hemmt, und Prokinetika wie Domperidon, Metoclopramid, Makrolide und Serotoninrezeptor-Agonisten und/oder -Antagonisten.69 Die Fundoplikatio ist eine effektive Langzeitbehandlung zur Verhinderung von gastroösophagealem Reflux. Obwohl Patienten mit schwerer ösophagealer Hypomotilität bei diesem Eingriff vorsichtig sein sollten, ist dieser Zustand keine absolute Kontraindikation.83 Darüber hinaus gibt es Hinweise darauf, dass die Fundoplikatio die Ösophagusfunktion bei Patienten mit GERD und ösophagealer Hypomotilität verbessern kann.84,85
Zusammenfassend lässt sich sagen, dass ösophageale Motilitätsstörungen, einschließlich der LES-Dysfunktion und der ösophagealen Peristaltikanomalie, wichtige Erkrankungen sind. Sie werden jedoch oft unterdiagnostiziert, da sich einige klinische Präsentationen mit der GERD überschneiden, die in der täglichen Praxis häufiger anzutreffen ist. Darüber hinaus ist die Ösophagusmanometrie nicht weit verbreitet und Allgemeinmediziner sind möglicherweise nicht mit diesem fortschrittlichen Ösophagusfunktionstest vertraut. Weitere Untersuchungen mit der Ösophagusmanometrie bei Patienten mit refraktären Ösophagussymptomen (z. B. Sodbrennen, Regurgitation und nicht-kardialen Brustschmerzen) und/oder respiratorischen Symptomen (z. B. chronischer Husten) unklarer Ursache könnten die einzigartige ösophageale Dysmotilitätsstörung aufdecken. Dies könnte Klinikern helfen, die geeignete Behandlung für ihre Patienten zu wählen.