XeF2 ist eine Abkürzung für die chemische Verbindung Xenon-Difluorid. Es ist sowohl ein starkes Fluorierungs- als auch ein Oxidationsmittel. Neben XeF2 gibt es weitere Xenon-Verbindungen wie XeF4 ( Xenon-Tetrafluorid) und XeF6 ( Xenon-Hexafluorid). Von diesen Verbindungen ist XeF2 die stabilste. Es ist ein weißer
kristalliner Feststoff, der für Fluorierungszwecke in elektrochemischen Verfahren und in Labors verwendet wird. XeF2 hat einen typischen ekelerregenden Geruch und zersetzt sich, wenn es mit Dampf oder Licht in Berührung kommt.
Es ist wichtig, seine Lewis-Struktur, Hybridisierung und Polarität zu kennen, um die chemischen Eigenschaften sowie die molekulare Geometrie der Verbindung zu verstehen. Lassen Sie uns nun alle Eigenschaften im Detail verstehen.
Inhalt
Xef2 Lewis-Struktur
Die Lewis-Struktur einer gegebenen chemischen Verbindung ist entscheidend für die Kenntnis aller physikalischen Eigenschaften und der chemischen Eigenschaften. Sie ist eine bildhafte Darstellung aller an der Bindungsbildung beteiligten Elektronen. Diese Struktur hilft beim Verständnis der Ladungen an den Molekülen der Verbindung. Die Elektronen, die an der Bindungsbildung teilnehmen, sowie die, die nicht teilnehmen, werden gemeinsam als Valenzelektronen bezeichnet.
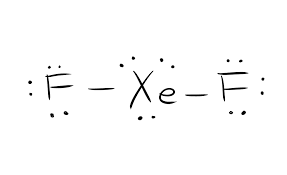
Elektronen, die an der Bindungsbildung teilnehmen, werden als bindende Elektronenpaare bezeichnet. Diejenigen, die sich nicht an der Bindungsbildung beteiligen, nennt man einsame Elektronenpaare. Um die verschiedenen Elektronentypen zu unterscheiden, werden sowohl bindende als auch einsame Elektronenpaare unterschiedlich dargestellt. Die Bindungen in der Verbindung werden als gerade Linien und die einsamen Elektronenpaare als Punkte dargestellt.
Die Lewis-Struktur basiert auf der Oktettregel. Diese Regel besagt, dass jedes Molekül acht Elektronen in der äußeren Schale eines Atoms haben sollte, um stabil zu sein. Sind mehr Elektronen vorhanden, dann gibt die Verbindung das Elektron ab. Sind hingegen weniger als acht Elektronen vorhanden, nimmt die Verbindung die Elektronen vom anderen Molekül auf, um stabil zu sein.
So gibt es für diese Verbindung XeF2 ein Molekül Xenon und zwei Moleküle Fluor. Ein einzelnes Xenon-Molekül hat acht Elektronen und ein Fluor-Molekül hat sieben Valenzelektronen.
Gesamtzahl der Valenzelektronen = Anzahl der Valenzelektronen für Xenon + Anzahl der Valenzelektronen für Fluor
=8+ 7*2
=8+14
=22
Die Gesamtzahl der Valenzelektronen für XeF2=22.
Hybridisierung von Xef2

Die Hybridisierung eines bestimmten Moleküls ist wichtig, um die Geometrie des Moleküls zu verstehen. Während der Bindungsbildung verbinden sich zwei oder mehr Orbitale mit unterschiedlichen Energieniveaus und bilden Hybridorbitale. In XeF2 hat die äußere Schale von Xenon acht Elektronen, von denen zwei Elektronen an der Bindungsbildung teilnehmen.
Im Grundzustand des Xenon sind 8 Elektronen in s2 p6 Orbitalen angeordnet. Im XeF2 hingegen hat das Xe-Molekül einen angeregten Zustand. Die Anordnung der Elektronen des Xenon ändert sich zu s2 p5 d1 mit zwei ungepaarten Elektronen. Die Hybridisierung des Zentralatoms Xe ist also sp3d. Somit ist die Hybridisierung des XeF2-Moleküls sp3d.
Xef2 Molekülgeometrie

Generell ist die Lewis-Struktur hilfreich, um die Molekülgeometrie einer gegebenen chemischen Verbindung zu verstehen. Da Xenon jedoch nicht leicht Bindungen bildet, ist diese Verbindung ein Ausnahmefall. Die molekulare Geometrie von Xenon-Difluorid kann durch die Kenntnis der VSEPR-Theorie verstanden werden. Diese Theorie basiert auf der Sterizahl des Zentralatoms und den Valenzelektronen der Verbindung. VSEPR ist eine Abkürzung für Valence Shell Electron Pair repulsion theory.
Hier ist die sterische Zahl für das zentrale Xenon-Atom 5. Das bedeutet, dass ein einzelnes Xenon-Molekül mit fünf Molekülen Bindungen eingehen kann. Hier in XeF2 bildet es aber nur mit zwei Fluoratomen Bindungen aus. Bei Xenon bilden zwei von acht Elektronen Bindungen mit den Fluoratomen. Diese sechs Elektronen sind nun die nicht-bindenden Elektronen. Diese drei einsamen Elektronenpaare verteilen sich in einer Anordnung, die auf der Äquatorialposition zu den gebundenen Elektronenpaaren liegt.
Die Form des Moleküls sollte gemäß der Hybridisierung trigonal bipyramidal sein, ist es aber nicht. XeF2 ist aufgrund der Anordnung der Fluoratome und der einsamen Elektronenpaare in symmetrischer Anordnung ein lineares Molekül.
Bindungswinkel
Nachdem wir nun die Molekülgeometrie des Xenondifluorid-Moleküls kennen, lässt sich der Bindungswinkel leicht verstehen. Es gibt zwei gebundene Elektronenpaare und drei einsame Elektronenpaare. Die einsamen Elektronenpaare befinden sich in der äquatorialen Position zu den gebundenen Paaren. Der Bindungswinkel zwischen den beiden an das Zentralatom gebundenen Paaren beträgt 180 Grad, so dass die Molekülgeometrie von XeF2 linear ist.
Xef2 Polarität
![]()
Die Polarität eines jeden Moleküls hängt von der Molekülgeometrie und der Hybridisierung der Verbindung ab. Im XeF2-Molekül sind zwei Fluoratome symmetrisch an den Außenseiten angeordnet, das Zentralatom Xenon befindet sich in der Mitte. Durch die symmetrische Anordnung der Valenzelektronen gibt es in der Verbindung kein Nettodipolmoment. Daher ist Xenon-Difluorid unpolar, da keine Polarität im Molekül beobachtet wird.
Abschließende Bemerkungen
Zusammenfassend kann man sagen, dass XeF2 22 Valenzelektronen besitzt, von denen drei einsame Elektronenpaare sind. Seine Hybridisierung ist sp3d. Nach der VSEPR-Theorie ist die Molekülgeometrie des Moleküls linear. Der Bindungswinkel von F-Xe-F beträgt 180 Grad. Da sich auf beiden Seiten des Zentralatoms Fluormoleküle befinden, gibt es kein Dipolmoment und somit auch keine Polarität. XeF2 ist aufgrund der symmetrischen Anordnung der gebundenen Elektronenpaare unpolar.