|
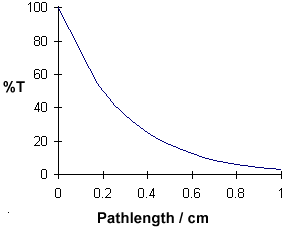
Longitud del camino / cm
|
0,4
|
0,6
|
0.8
|
||
| %T |
100
|
50
|
25 | 12.5 | |
|
Absorbancia
|
0,6
|
0,9
|
1,2 |
1.5
|
 |
 |
A = ebc nos dice que la absorbancia depende de la cantidad total del compuesto absorbente en el recorrido de la luz por la cubeta. Si graficamos la absorbancia contra la concentración, obtenemos una línea recta que pasa por el origen (0,0).
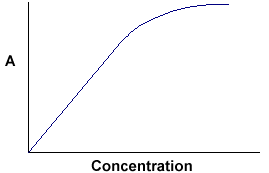 |
Nota que la Ley no se cumple a altas concentraciones. Esta desviación de la Ley no se trata aquí. |
La relación lineal entre la concentración y la absorbancia es sencilla y directa, por lo que preferimos expresar la ley de Beer-Lambert utilizando la absorbancia como medida de la absorción en lugar del %T.
Pregunta : ¿Cuál es el significado de la absorbancia molar, e ? Para empezar reordenaremos la ecuación A = ebc :
e = A / bc
En palabras, esta relación se puede enunciar como «e es una medida de la cantidad de luz absorbida por unidad de concentración».
La absorbencia molar es una constante para una sustancia concreta, por lo que si la concentración de la solución se reduce a la mitad también lo hace la absorbencia, que es exactamente lo que se espera.
Tomemos un compuesto con un valor muy alto de absorbencia molar, digamos 100.000 L mol-1 cm-1, que está en una solución en una cubeta de 1 cm de longitud de paso y da una absorbencia de 1.
e = 1 / 1 ‘ c
Por lo tanto, c = 1 / 100.000 = 1 ‘ 10-5 mol L-1
Ahora tomemos un compuesto con un valor muy bajo de e, digamos 20 L mol-1 cm-1 que está en solución en una cubeta de 1 cm de longitud de paso y da una absorbancia de 1.
e = 1 / 1 ‘ c
Por lo tanto, c = 1 / 20 = 0.05 mol L-1
La respuesta es ahora obvia – un compuesto con una alta absorbencia molar es muy eficaz en la absorción de la luz (de la longitud de onda apropiada), y por lo tanto las bajas concentraciones de un compuesto con una alta absorbencia molar pueden ser fácilmente detectadas.
Pregunta : ¿Cuál es la absorbencia molar de los iones Cu2+ en una solución acuosa de CuSO4? Es o bien 20 o bien 100.000 L mol-1 cm-1
Respuesta : Supongo que piensas que el valor más alto es el correcto, porque las soluciones de sulfato de cobre que has visto suelen tener un bonito color azul brillante. Sin embargo, el valor real de la absorbencia molar es de 20 L mol-1 cm-1. El color azul brillante se ve porque la concentración de la solución es muy alta.
El b-caroteno es un compuesto orgánico que se encuentra en las verduras y es responsable del color de las zanahorias. Se encuentra en concentraciones extremadamente bajas. ¡No te sorprenderá saber que la absorbencia molar del b-caroteno es de 100.000 L mol-1 cm-1 !
Revisa lo que has aprendido
Ahora deberías tener una buena comprensión de la Ley de Beer-Lambert; las diferentes formas en que podemos informar de la absorción, y cómo se relacionan entre sí. También deberías entender la importancia de la absorbencia molar, y cómo ésta afecta al límite de detección de un determinado compuesto.
![]()