|
Comprimento do caminho / cm
|
|
%T
|
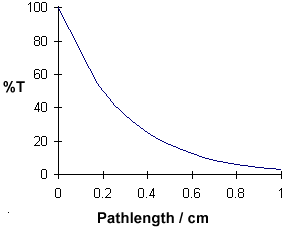 |
 |
A = ebc diz-nos que a absorvância depende da quantidade total do composto absorvente no caminho da luz através da cuvette. Se traçarmos a absorvância contra a concentração, obtemos uma linha recta que passa pela origem (0,0).
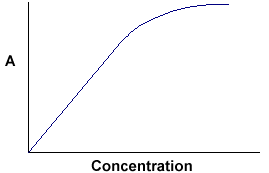 |
Nota que a Lei não é obedecida em concentrações elevadas. Este desvio da Lei não é tratado aqui. |
A relação linear entre concentração e absorvância é simples e directa, razão pela qual preferimos expressar a Lei Beer-Lambert usando a absorvância como medida de absorção em vez de %T.
Questão : Qual é o significado da absorvância molar, e ?
Resposta : Para começar, vamos reorganizar a equação A = ebc :
p>e = A / bc
Em palavras, esta relação pode ser declarada como “e é uma medida da quantidade de luz absorvida por unidade de concentração”.
A absorvtividade molar é uma constante para uma determinada substância, portanto, se a concentração da solução for reduzida para metade, também o é a absorvância, que é exactamente o que se esperaria.
Deixe-nos tomar um composto com um valor muito elevado de absorvância molar, digamos 100.000 L mol-1 cm-1, que está numa solução numa cubeta de 1 cm de comprimento e dá uma absorvância de 1.
e = 1 / 1 ‘ c
Por isso, c = 1 / 100.000 = 1 ‘ 10-5 mol L-1
Agora tomemos um composto com um valor muito baixo de e, digamos 20 L mol-1 cm-1 que está em solução numa cubeta de 1 cm de comprimento e dá uma absorvância de 1,
e = 1 / 1 ‘ c
Por isso, c = 1 / 20 = 0.05 mol L-1
A resposta é agora óbvia – um composto com uma elevada absorvância molar é muito eficaz na absorção da luz (do comprimento de onda apropriado), e por isso podem ser facilmente detectadas baixas concentrações de um composto com uma elevada absorvância molar.
Questão: Qual é a absorvância molar dos iões Cu2+ numa solução aquosa de CuSO4 ? É 20 ou 100.000 L mol-1 cm-1
Resposta: suponho que o valor mais alto é correcto, porque as soluções de sulfato de cobre que viu são geralmente de uma bela cor azul brilhante. No entanto, o valor real da absorvtividade molar é 20 L mol-1 cm-1 ! A cor azul brilhante é vista porque a concentração da solução é muito elevada.
b-caroteno é um composto orgânico encontrado em vegetais e é responsável pela cor das cenouras. Encontra-se em concentrações excessivamente baixas. Talvez não se surpreenda ao saber que a absorvtividade molar do b-caroteno é de 100.000 L mol-1 cm-1 !
Revê a tua aprendizagem
Tem agora uma boa compreensão da Lei da Cerveja-Lambert; as diferentes formas em que podemos relatar a absorção, e como se relacionam umas com as outras. Deve também compreender a importância da absorvtividade molar, e como isto afecta o limite de detecção de um determinado composto.
![]()