Nel 1889, Svante Arrhenius propose l’equazione di Arrhenius dalle sue osservazioni dirette dei grafici delle costanti di velocità rispetto alle temperature:
L’energia di attivazione, Ea, è l’energia minima che le molecole devono possedere per reagire e formare un prodotto. La pendenza del grafico di Arrhenius può essere usata per trovare l’energia di attivazione. Il grafico di Arrhenius può anche essere usato estrapolando la linea all’intercetta y per ottenere il fattore pre-esponenziale, A. Questo fattore è significativo perché A=p×Z, dove p è un fattore sterico e Z è la frequenza di collisione. Il fattore pre-esponenziale, o frequenza, è legato alla quantità di volte in cui le molecole colpiranno nell’orientamento necessario per causare una reazione. È importante notare che l’equazione di Arrhenius si basa sulla teoria della collisione. Essa afferma che le particelle devono collidere con l’orientamento appropriato e con abbastanza energia. Ora che abbiamo ottenuto l’energia di attivazione e il fattore pre-esponenziale dal grafico di Arrhenius, possiamo risolvere la costante di tasso a qualsiasi temperatura usando l’equazione di Arrhenius.
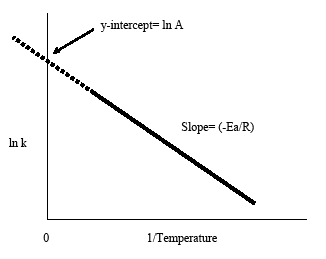
Il grafico di Arrhenius si ottiene tracciando il logaritmo della costante di tasso, k, contro l’inverso della temperatura, 1/T. La linea risultante, inclinata negativamente, è utile per trovare le componenti mancanti dell’equazione di Arrhenius. L’estrapolazione della linea verso l’intercetta y produce il valore di ln A. La pendenza della linea è uguale all’energia di attivazione negativa divisa per la costante del gas, R. Come regola generale nella maggior parte delle reazioni biologiche e chimiche, la velocità di reazione raddoppia quando la temperatura aumenta ogni 10 gradi Celsius.
Guardando l’equazione di Arrhenius, il denominatore della funzione esponenziale contiene la costante dei gas, R, e la temperatura, T. Questo è solo il caso quando si tratta di moli di una sostanza, perché R ha le unità di J/molK. Quando si tratta di molecole di una sostanza, la costante del gas nel dominatore della funzione esponenziale dell’equazione di Arrhenius è sostituita dalla costante di Boltzmann, kB. La costante di Boltzmann ha le unità J/K. A temperatura ambiente, kBT, è l’energia disponibile per una molecola a 25 C o 273K, ed è uguale a circa 200 numeri d’onda.
È importante notare che la decisione di usare la costante dei gas o la costante di Boltzmann nell’equazione di Arrhenius dipende principalmente dalla cancellazione delle unità. Per prendere il log inverso di un numero, il numero deve essere senza unità. Quindi tutte le unità nel fattore esponenziale devono annullarsi. Se l’energia di attivazione è in termini di joule per mole, allora la costante dei gas dovrebbe essere usata nel dominatore. Tuttavia, se l’energia di attivazione è in unità di joule per molecola, allora dovrebbe essere usata la costante K.
- Equazione di Arrhenius per Mole \
- Equazione di Arrhenius per Molecola \
Equazione di Arrhenius “Linearizzata”
L’equazione di Arrhenius (Equazione \ref{eq1}) può essere riorganizzata per affrontare situazioni specifiche. Per esempio, prendendo il logaritmo di entrambi i lati si ottiene l’equazione di cui sopra nella forma y=-mx+b.
Allora, un grafico di \(\ln k\) vs. \(1/T\) e tutte le variabili può essere trovato.
- (y=ln k\)
- (m=-Ea/RT\)
- (x=1/T\)
- (b=ln A\)
Questa forma dell’equazione di Arrhenius rende facile determinare la pendenza e l’intercetta y da un grafico di Arrhenius. È anche conveniente notare che l’equazione di cui sopra mostra la connessione tra temperatura e costante di tasso. Come la temperatura aumenta, la costante di tasso diminuisce secondo il grafico. Da questa connessione possiamo dedurre che la costante di tasso è inversamente proporzionale alla temperatura.
Forma integrata
È utile anche la forma integrata dell’equazione di Arrhenius (Equazione \ref{eq3}). Questa variazione dell’equazione di Arrhenius comporta l’uso di due diagrammi di Arrhenius costruiti sullo stesso grafico per determinare l’energia di attivazione. L’equazione di cui sopra mostra l’effetto della temperatura su più costanti di velocità. Questo permette di dedurre facilmente la sensibilità delle costanti di tasso all’energia di attivazione e ai cambiamenti di temperatura. Se l’energia di attivazione è alta per un dato intervallo di temperatura, allora la costante di tasso è altamente sensibile; i cambiamenti di temperatura hanno un effetto significativo sulla costante di tasso. Se l’energia di attivazione è bassa per un dato intervallo di temperatura, allora la costante di velocità è meno sensibile, e i cambiamenti di temperatura hanno poco effetto sulla costante di velocità. Questo fenomeno è illustrato graficamente nell’esempio seguente:
| 1/Temp | 0.0085 | 0.0075 | 0.0065 | 0.0055 | 0.0045 | 0.0035 |
|---|---|---|---|---|---|---|
| lnk (grande Ea) | 3 | 2.5 | 2 | 1.5 | 1 | 0.5 |
| lnk (piccolo Ea) | 1.8 | 1.7 | 1.6 | 1.5 | 1.4 | 1.3 |
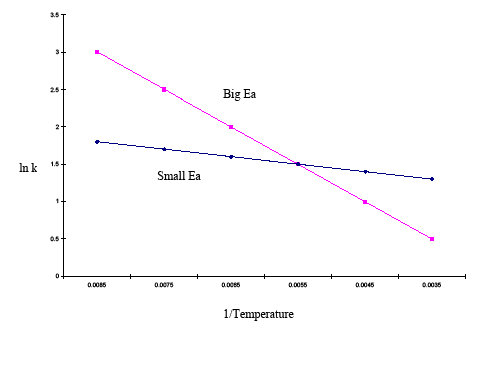
Il grafico sopra mostra che il grafico con la pendenza più ripida ha una maggiore energia di attivazione e quello con la pendenza più piatta ha una minore energia di attivazione. Questo significa che nello stesso intervallo di temperatura, una reazione con un’energia di attivazione più alta cambia più rapidamente di una reazione con un’energia di attivazione più bassa.
Significato biologico
Il grafico di Arrhenius può diventare non lineare se i passi diventano limitanti a temperature diverse. Un esempio del genere si può trovare con Fox e collaboratori nel 1972 con il trasporto di beta-glicosidi in E. coli. Le differenze nelle temperature di transizione sono dovute alla composizione degli acidi grassi nelle membrane cellulari. La differenza di stato di transizione è il risultato del brusco cambiamento di fluidità della membrana. Un altro esempio comprende un calo improvviso a basse 1/T (alte temperature), un risultato della denaturazione delle proteine.
Punti chiave
- I grafici di Arrhenius mostrano che i tassi di reazione sono inversamente proporzionali ai cambiamenti di temperatura
- La pendenza negativa del grafico di Arrhenius dà l’energia di attivazione, Ea: slope = -Ea/R
- L’estrapolazione del grafico di Arrhenius all’intercetta y dà lnA
- Il grafico di Arrhenius mostra come l’energia di attivazione e la temperatura influenzino la sensibilità della velocità di reazione
Problemi pratici
1. T/F L’Ea calcolata dall’equazione di Arrhenius dà un valore esatto.
2. Descrivi la relazione tra temperatura ed Ea e fai degli esempi.
3. Usando le seguenti informazioni:
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8.314 J mol/K
Calcolare k a 27° C con unità appropriate.
4. Usando le informazioni dal problema 3, calcolare k a 37° C con unità appropriate.
5. Usando l’equazione integrata risolvere per Ea usando:
k1=7.78×10-7 a T1=273 K
k2=3.46×10-5 a T2=298 K
Risposte
- Falso: Ea è un valore medio o “apparente”.
- Quando la temperatura aumenta, la costante di velocità diminuisce quando l’equazione di cui sopra è tracciata. Lo stesso è vero quando la temperatura diminuisce, la costante di tasso aumenta. Da questa connessione, la costante di velocità è inversamente proporzionale alla temperatura.
- k= 8.727 sec-1
- k=23.02 sec-1
- Ea=1.026×105 J/mol
Contribuenti e attribuzioni
- David Johns e Andra Hutton (UC Davis)