Come funzionano i tamponi
Come hai visto nel calcolo del pH delle soluzioni, solo una piccola quantità di un acido forte è necessaria per alterare drasticamente il pH. Per certi esperimenti, tuttavia, è desiderabile mantenere un pH abbastanza costante mentre acidi o basi vengono aggiunti alla soluzione per reazione o dallo sperimentatore. I buffer sono progettati per riempire quel ruolo. I chimici usano abitualmente i buffer per moderare il pH di una reazione. La biologia trova molteplici usi per i tamponi che vanno dal controllare il pH del sangue al garantire che l’urina non raggiunga livelli dolorosamente acidi.
Un tampone è semplicemente una miscela di un acido debole e la sua base coniugata o una base debole e il suo acido coniugato. I tamponi funzionano reagendo con qualsiasi acido aggiunto o base per controllare il pH. Per esempio, consideriamo l’azione di un tampone composto dalla base debole ammoniaca, NH3, e il suo acido coniugato, NH4+. Quando l’acido cloridrico viene aggiunto a questo tampone, l’NH3 “assorbe” il protone dell’acido per diventare NH4+. Quando NaOH viene aggiunto allo stesso tampone, lo ione ammonio dona un protone alla base per diventare ammoniaca e acqua. qui il tampone serve anche a neutralizzare la base. come mostra l’esempio precedente, un tampone funziona sostituendo un acido forte o una base con uno debole. Il protone dell’acido forte è sostituito dallo ione ammonio, un acido debole. La base forte OH- è stata sostituita dalla base debole ammoniaca. Queste sostituzioni di acidi forti e basi per quelli deboli danno ai tamponi la loro straordinaria capacità di moderare il pH.
Calcolo del pH delle soluzioni tamponate
I tamponi devono essere scelti per l’appropriato intervallo di pH che sono chiamati a controllare. L’intervallo di pH di una soluzione tamponata è dato dall’equazione di Henderson-Hasselbalch. Per lo scopo della derivazione, immagineremo un tampone composto da un acido, HA, e la sua base coniugata, A-. Sappiamo che la costante di dissociazione pKa dell’acido è data da questa espressione:

L’equazione può essere riformulata come segue:
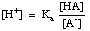
Prendendo il -log di questa espressione e riorganizzando i termini per renderli tutti positivi si ottiene l’equazione di Henderson-Hasselbalch: